无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2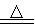 AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝
①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)。
(2)滤液A的主要成分(填写化学式)。
(3)反应①的离子方程式是。
(4)反应②的化学反应方程式是。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3 (水层)+ 6HT(有机层) 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3 (有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是(从平衡移动角度回答)。
液氨是一种良好的储氢物质。
已知:① 2NH3(g)  N2 (g) + 3H2(g)ΔH =+92.4 kJ·mol-1
N2 (g) + 3H2(g)ΔH =+92.4 kJ·mol-1
② 液氨中2NH3(l)  NH2- + NH4+
NH2- + NH4+
(1)氨气自发分解的反应条件是(填“低温”或“高温”)。
(2)图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。反应的活化能最大 的是(填催化剂的化学式)。
(3)其他条件相同,反应①在不同催化剂作用下反应相同时间后,氨气的转化率随反应温度的变化如图2所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点氨气的转化率高于b点,原因是。
③请在图2中再添加一条Ni催化分解氨气过程的总趋势曲线。
④假设Ru催化下,温度为750℃时,氨气的初始浓度为c0,平衡转化率为40%,则该温度下此反应的 平衡常数K = 。
(4)用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是。
乙酰水杨酸是一种使用广泛的解热镇痛剂。合成原理是:
(1)乙酰水杨酸的分子式为,1mol乙酰水杨酸最多能与mol H2反应。
(2)上面反应的反应类型是。
(3)有关水杨酸的说法,不正确的是。
| A.能与溴水发生取代反应和加成反应 |
| B.可发生酯化反应和水解反应 |
| C.1mol水杨酸最多能与2mol NaOH反应 |
| D.遇 FeCl3溶液显紫色 |
(4)乙酰水杨酸与足量KOH溶液反应的化学方程式为。
(5)乙酰氯(CH3COCl )也可以与水杨酸反应生成乙酰水杨酸,请写出化学反应方程式(不写条件)。
(6)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式:。
Ⅰ.能遇FeCl3溶液显色
Ⅱ.苯环上只有2种一溴取代物
Ⅲ.1mol该化合物能分别与含4mol Br2的溴水或4mol H2反应
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化还原法消除氮氧化物的转化如下:
①反应I为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是mol。
②反应II中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是。
(2)硝化法是一种古老的生产硫酸的方法,同时实现氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g)△H=-41.8 kJ·mol-1
SO3(g)+NO(g)△H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1。
2SO3(g) △H=-196.6 kJ·mol-1。
写出NO和O2反应生成NO2的热化学方程 式。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K=。
CH3OCH3(g)+3H2O(g);该反应 平衡常数表达式为K=。
(4)合成气CO和H2在一定条件下能发生如下反应:
CO(g) +2H2(g) CH3OH(g)△H<0。
CH3OH(g)△H<0。
在容积均为V L的I、II、III三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数υ(CO)%如图所示,
此时I、II、III三个容器中一定达到化学平衡状态的是;若三个容器内的反应再经过一段时间后都达到化学平衡时,CO转化率最大的反应温度是。
(5)据报道以二氧化碳为原料,采用特殊的电极电解强酸性的二氧化碳水溶液可得到多种燃料,其原理如下图所示。电解时,b极上生成乙烯的电极反应式为___________________.
查尔酮类化合物是黄酮类药物的主要合成中间体。
(1)下列查尔酮类化合物I的说法正确的是。
| A.加入溴的四氯化碳溶液,溶液褪色 |
| B.可发生加成或取代反应 |
| C.不与NaOH溶液发生反应 |
| D.加入新制的氢氧化铜有红色沉淀生成 |
(2)反应①是制取查尔酮类化合物的一种方法:
化合物III的分子式是,1mol化合物III最多能与mol H2发生加成反应。
(3)化合物II可由化合物IV(分子式:C8H10O)在Cu催化氧化下制得,则化合物IV的结构简式为,化合物IV的一种同分异构体V为芳香族化合物,其核磁共振氢谱上有四组峰,峰面积之比为为1∶1∶2∶6,则V的结构简式为(任写一种)。
(4)聚合物 是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为。
是一种高分子材料,请利用类似反应①方法,用丙烯和丙醛为有机物原料合成该聚合物的单体。合成过程中涉及的反应方程式为。