短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: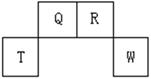
(1)W在周期表中的位置是 , Q、R、T三种元素原子的半径从大到小排列顺序 (用元素符号表示),Q的最高价氧化物的电子式 ,R气态氢化物分子的结构式为 ;
(2)元素的原子得电子能力:Q W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点 (填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是 (填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号 ,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号 。
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.6 |
0.75 |
0.82 |
| 最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
| -2 |
|
|
-3 |
-1 |
|
-3 |
|
某pH=1的溶液X,其中可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32-、SO42ˉ、SiO32ˉ、NO3ˉ中的一种或几种离子,取200mL溶液进行实验,其现象及转化如下图。反应过程中有一种气体是红棕色。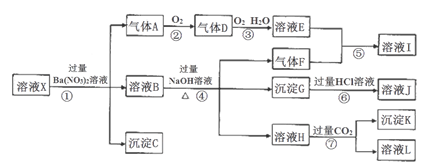
请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有___________;
(2)溶液X中,关于NO3ˉ的判断一定正确的是______;
a.一定有b.一定没有c.可能有
(3)①中产生气体A的离子方程式为_________________;
(4)⑦中生成沉淀K的离子方程式为_______________;
(5)溶液X中不能确定的离子是________,若要用实验证明该离子一定不存在,其中最可靠的化学方法为_______________________;
(6)若实验测定A、F、K均为0.01mol,试确定沉淀C及其物质的量:_______________。
磷的单质和化合物是重要的化工产品。查阅资料可知:亚磷酸(H3PO3)、次磷酸(H3PO2)以及它们的盐都有较强还原性,可用于化学镀银或镀镍;亚磷酸是中强酸,它与足量的NaOH溶液反应生成Na2HPO3。试回答下列问题:
(1)Na2HPO3中P元素的化合价为_____________________;
(2)Na2HPO3是_______________(填“正盐”或者“酸式盐”),其溶液的pH________7 (填“>”、“=”或“<”)。
(3)利用次磷酸与硝酸银溶液反应进行化学镀银,反应中氧化剂与还原剂的物质的量之比为4︰1,该反应的化学方程式为:__________________。
(4)次磷酸钠(NaH2PO2)可用于化学镀镍。镀镍溶液中含Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)____Ni2+ +____H2PO2-+_____==____Ni+ + ______H2PO3-+ _______
(b)6H2PO2-+2H+ =2P+4H2PO3-+3H2↑
①请配平反应式(a);
②依据反应式(b),反应消耗掉6 mol H2PO2-时转移电子的物质的量为____________。
碱金属元素的单质和化合物在日常生活和化工生产中应用广泛。
(1)钠的原子结构示意图为______________________。
(2)过氧化钠可作为呼吸面具和潜水艇中的供氧剂。写出过氧化钠与二氧化碳反应的化学方程式:___。
(3)氯碱工业是利用电解饱和食盐水获取一系列化工产品的过程。若利用电解饱和食盐水所得的气体制100t 36.5%的浓盐酸,理论上至少需要消耗NaCl_________________ t。
(4)某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
①分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A的名称为_______。
②称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,发现Na2CO3固体完全溶解,而NaHCO3固体还有剩余,由此可以得出结论:___________。向所得溶液中滴入酚酞后,观察到的现象是________________。
③某同学为探究Na2CO3和NaHCO3与CaCl2溶液的反应,将两种固体分别配制成0.5 mol/L的溶液,设计如下方案并对反应现象做出预测:
| 实验方案 |
预测现象 |
预测依据 |
| 操作1:向2mL Na2CO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
有白色沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32-=" " CaCO3↓。 |
| 操作2:向2mL NaHCO3溶液中滴加1 mL 0.5 mol/L CaCl2溶液 |
无白色沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为:___________________________。
亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程: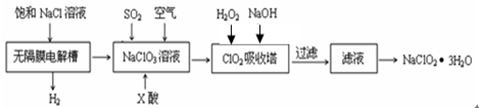
(1)反应生成ClO2气体需要X酸酸化,X酸可以为。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.H2C2O4溶液 |
(2)吸收塔内的温度不能过高的原因为。
(3)ClO2被S2-还原为ClO2-、Cl-转化率与pH关系如图。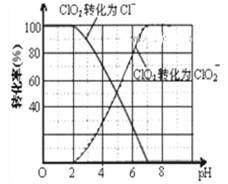
写出pH≤2时ClO2与S2-反应的离子方程式_______。
(4)ClO2对污水中CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,生成了两种无毒无害的气体,其离子反应方程式___________________________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
A、B、C、D、E为五种短周期元素。A、B、C是原子序数递增的同周期元素,且最外层电子数之和为15,A与C可形成常见的AC2分子;D元素的某种原子中无中子;E是地壳中含量最高的金属元素。请回答下列问题:
(1)AC2分子的电子式为____________________。
(2)比较BD3与D2C的稳定性:_______比________稳定(填化学式)。
(3)五种元素的原子半径由大到小的顺序是__________________(填元素符号)。
(4)E的单质与NaOH溶液反应生成的盐的溶液与少量AC2反应的离子方程式为___________________。
(5)化合物EB溶于强碱生成氨气,写出EB与NaOH溶液反应的化学方程式______________________。
(6)工业生产的EB产品往往含有碳和氧化铝杂质,现取10 g样品置于反应器中,通入2.016L(标准状况下)O2,在高温下充分反应后,所得气体的密度是相同状况下氢气的15倍(EB不与O2反应)。该样品中含杂质碳的质量分数为______________。