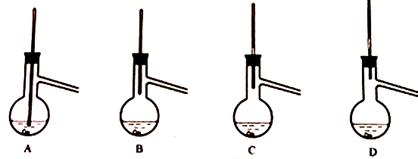
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________ (填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(2) 简述证明HCO3-、CO32-已完全沉淀的实验操作_________________________。
(3) 过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有________________________。
(4) 将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
方案二:量气法。量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积,由此计算混合物中w (Na2CO3)。
(1)装置中导管a的作用是 。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①_______________________________,
②_________________________________,
③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则 产生CO2的体积为 mL。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L盐酸进行滴定到终点(已知终点时反应H++CO32- =HCO3-恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________。
(3)此法测得w(Na2CO3)= %。
某兴趣小组为探究氮的化合物的性质,设计了如图所示实验装置,A为气体发生装置。
按上图连接好各仪器,检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的无色气体通过后面装置。片刻后可观察到F中铜片慢慢溶解。请回答下列问题:
(1)A制备气A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2)相对应的装置可以是________(填字母)。
(2)写出题干装置C中发生反应的化学方程式________,C处加热片刻后撤去酒精灯,铂丝仍保持红热,原因是________________________________________。
(3)铜片完全溶解后,发现F装置中溶液呈绿色,加水稀释后呈蓝色,有同学得出两种结论:①浓Cu(NO3)2溶液呈绿色,稀Cu(NO3)2溶液呈蓝色;②Cu(NO3)2溶液呈蓝色,呈绿色是由于溶液溶解过量的NO2,试设计实验验证哪一种结论正确______________________________________________________________。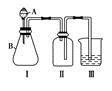 (4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
(4)该兴趣小组同学共同设计了如图所示的实验装置,利用装置Ⅰ、Ⅱ制取气体,请回答下列问题:
①甲同学认为:利用装置Ⅱ可以收集H2、NH3等气体,但不能收集O2和NO,理由是______________________________________________。
②乙同学认为:利用装置Ⅱ作简易改进(不改变仪器装置),可收集NO、O2,改进的方法是__________________________________________。
用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O,工艺流程如下(部分操作和条件略)
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品。
(1)H2SO4溶解A12O3的离子方程式是
(2)KMnO4氧化Fe2+的离子方程式补充完整:
(3)已知:生成氢氧化物沉淀的pH
| Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
|
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1mol·L-1
根据表中数据解释步骤Ⅱ的目的。
(4)己知:一定条件下,MnO4-可与Mn2+反应生成MnO2,
①向Ⅲ的沉淀中加入浓HCI并加热,能说明沉淀中存在MnO2的现象是。
②Ⅳ中加入MnSO4的目的是。
某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表: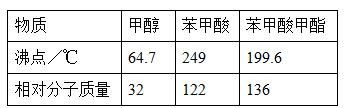
I.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式,甲醇过量的原因。
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用装置(填“甲”、“乙”、“丙”)。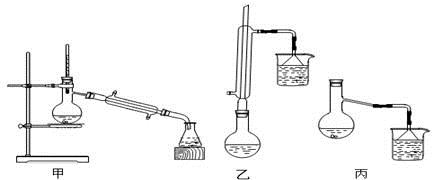
Ⅱ.粗产品的精制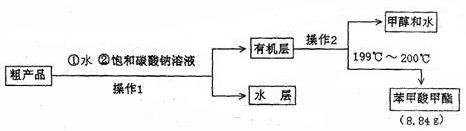
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为,操作II为。
(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是。
(6)苯甲酸甲酯的产率为。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与
共热制取
并进行相关实验。
①下列收集
的正确装置是。
②将
通入水中,所得溶液中具有氧化性的含氯粒子是。
③设计实验比较
和
的氧化性,操作与现象是:取少量新制氯水和
于试管中,。
(2)能量之间可以相互转化:电解食盐水制备
是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:
,
,
;铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图,并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②铜片为电极之一,
为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极。
③甲乙两种原电池中可更有效地将化学能转化为电能的是,其原因是。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选作阳极。
实验室制备苯乙酮的化学方程式为: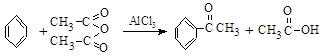
制备过程中还有 ↑等副反应。
↑等副反应。
主要实验装置和步骤如下: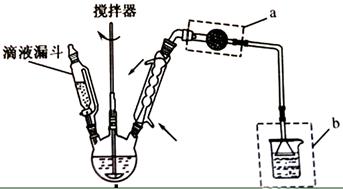
(I)合成:在三颈瓶中加入20
无水
和30
无水苯。为避免反应液升温过快,边搅拌边慢慢滴加6
乙酸酐和10
无水苯的混合液,控制滴加速率,使反应液缓缓回流。滴加完毕后加热回流1小时。
(Ⅱ)分离与提纯:
①边搅拌边慢慢滴加一定量浓盐酸与冰水混合液,分离得到有机层
②水层用苯萃取,分液
③将①②所得有机层合并,洗涤、干燥、蒸去苯,得到苯乙酮粗产品
④蒸馏粗产品得到苯乙酮。回答下列问题:
(1)仪器
的名称:;装置
的作用:。
(2)合成过程中要求无水操作,理由是。
(3)若将乙酸酐和苯的混合液一次性倒入三颈瓶,可能导致。
| A. | 反应太剧烈 | B. | 液体太多搅不动 | C. | 反应变缓慢 | D. | 副产物增多 |
(4)分离和提纯操作②的目的是。该操作中是否可改用乙醇萃取?(填"是"或"否"),原因是_。
(5)分液漏斗使用前须洗净备用。萃取时,先后加入待萃取液和萃取剂,经振摇并后,将分液漏斗置于铁架台的铁卷上静置片刻,分层。分离上下层液体时,应先,然后打开活塞放出下层液体,上层液体从上口倒出。
(6)粗产品蒸馏提纯时,下来装置中温度计位置正确的是_,可能会导致收集到的产品中混有低沸点杂质的装置是_。