决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
| 氟化物 |
NaF |
MgF2 |
SiF4 |
| 熔点/K |
1266 |
1534 |
183 |
解释MgF2与SiF4熔点差异的原因 。
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
| 电离能/kJ·mol-1 |
I1 |
I2 |
I3 |
I4 |
| A |
578 |
1817 |
2745 |
11578 |
| B |
738 |
1451 |
7733 |
10540 |
则A的电负性 B的电负性(填“>”、“<”或“=”)。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。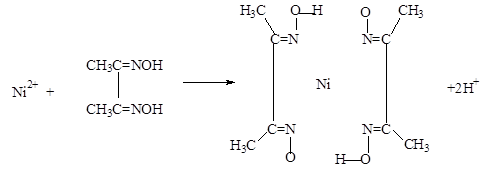
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。
(1) 现有下列短周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方:
写出下列编号所代表的元素符号:①____,②____,④____,⑤____,⑥____。
(2) 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为:
由上表的数据可知,在水溶液中上述化合物发生复分解反应的化学方程式为______________________,在液氨溶液中发生复分解反应的化学方程式为______________________________________________。
(3) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。三种物质和铁发生反应的顺序为___________,第一步反应的离子方程式为________,由图可知溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为__________。
氧化还原反应规律是化学学科的重要规律之一。按要求回答下列问题:
(1) 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑,此反应中B元素的化合价没有发生变化,则NaBH4中H的化合价为___________,该反应氧化产物是______________,还原产物是______________。
(2) 有下列三个反应:
①Cl2+FeI2=FeCl2+I2;②2Fe2++Br2=2Fe3++2Br-;③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
①根据以上方程式可以得到Fe2+、Co2+、Br-、I-还原性由强的弱的顺序为_________;
②1molCo2O3能氧化HCl的物质的量_____________。
(3) 完成并配平下列化学反应方程式:
□KMnO4+□H2C2O4+□________ □CO2+□K2SO4+□MnSO4+□H2O
□CO2+□K2SO4+□MnSO4+□H2O
(4)一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2H+ +Zn=Zn2++H2↑,可拆写为氧化反应式:Zn-2e-=Zn 2+,还原反应式:2H++ 2e-=H2↑。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
①将2Fe3++Cu= 2Fe2+ +Cu2+拆写为两个“半反应式”:其中,氧化反应式为。
②由①中的反应,可设计成如右图所示的原电池:
若电极a为Cu ,电解质溶液甲的化学式为;
电极b处的电极反应式为。
化学反应在工农业生产中有着重要的应用。按要求回答下列问题:
(1)利用化学反应可以制备许多物质。
①实验室用铜制备NO的离子方程式为___________________。
②可用Al和Fe2O3制Fe,该反应的化学方程式为___________________。
③海水提溴过程中,向浓缩的海水中通入氯气,再用热空气吹出生成的溴,然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-。这两步反应的离子方程式分别为__________、___________。
(2)化学反应能为人类生产生活提供能源。
①由反应CH4 +2O2 CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
CO2 +2H2O,可以设计出以NaOH溶液为电解质溶液的燃料电池,该电池工作时负极的电极反应式为:______________。
②2011年山东高考化学中曾提到钠硫高能电池,右图是该电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS=Na2Sx。该电池负极为________(填化学式),正极的电极反应式为 。用该电池作电源进行粗铜精炼时,当得到64g精铜时,理论上该电池负极消耗的质量为_____g。
从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质.
(1)下列说法正确的是(填字母).
| A.元素电负性由大到小的顺序为F>O>N |
| B.一个苯分子含3个π键和6个σ键 |
| C.氯化钠和氯化铯晶体中氯离子的配位数相同 |
| D.第一电离能的大小为Br>Se>As |
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为.光气(COCl2)各原子最外层都满足8电子稳定结构,COCl2分子空间构型为(用文字描述).
(3)Cu 2+基态的电子排布式为.向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为,不考虑空间构型,其内界结构可用示意图表示为.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
⑴一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________(填字母)。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系中SO3的体积分数保持不变 d.每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________。
⑵新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
⑶右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。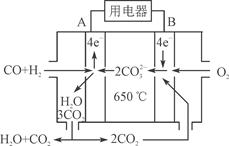
⑷工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3=2NaNO2+CO2
2NO2+Na2CO3=NaNO2+NaNO3+CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为
____________。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。