从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)海水淡化的方法主要有________(填一种)。
(2)从海水中提取镁的流程如下图所示: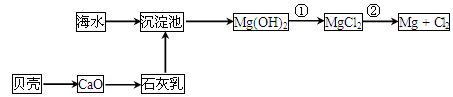
反应①的离子方程式为________________________________________________。
反应②的化学方程式为________________________________________________。
(3)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为________________________________________________。
碳酸锂广泛应用于陶瓷和医药等领域。已
-锂辉石(主要成分为
)为原材料制 备
的工艺流程如下:
备
的工艺流程如下:

已知:
、
、
和
以氢氧化物形式完全沉淀时,溶液的
分别为3.2、5.2、9.7和12.4;
、
和
在303
下的溶解度分别为34.2
、12.7
和1.3
。
(1)步骤Ⅰ前,
锂辉石要粉碎成细颗粒的目的是.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有
,另含有
等杂质,需在搅拌下加入(填"石灰石"、"氯化钙"或"稀硫酸")以调节溶液的
到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的
溶液、石灰乳和
溶液依次加入浸出液中,可除去的杂技金属离子有。
(4)步骤Ⅲ中,生成沉淀的离子方程式为。
(5)从母液中可回收的主要物质是。
硼酸
在食品、医药领域应用广泛。
(1)请完成
气体与水反应的化学方程式:
+
=
+。
(2)在其他条件相同时,反应
+
 +
中,
3的转化率
在不同温度下随反应时间
的变化见图12,由此图可得出:
+
中,
3的转化率
在不同温度下随反应时间
的变化见图12,由此图可得出:

①温度对应该反应的反应速率和平衡移动的影响是_
②该反应的
0(填"<"、"="或">").
(3)
溶液中存在如下反应:
(
)+
(
) -(
)+
+(
)已知0.70
-1
溶液中,上述反应于298
达到平衡时,
(
+)="2." 0 × 10-5
-1,
(
)≈
(
),水的电离可忽略不计,求此温度下该反应的平衡常数
(
)的平衡浓度不列入
的表达式中,计算结果保留两位有效数字)
-(
)+
+(
)已知0.70
-1
溶液中,上述反应于298
达到平衡时,
(
+)="2." 0 × 10-5
-1,
(
)≈
(
),水的电离可忽略不计,求此温度下该反应的平衡常数
(
)的平衡浓度不列入
的表达式中,计算结果保留两位有效数字)
固定和利用
能有效地利用资源,并减少空气中的温室气体。
与化合物Ⅰ反应生成化合物Ⅱ,与化合物Ⅲ反应生成化合物Ⅳ,如反应①和②所示(其他试剂、产物及反应条件均省略)。
(1)化合物Ⅰ的分子式为,1
该物质完全燃烧需消耗
。
(2)由 通过消去反应制备Ⅰ的化学方程式为(注明反应条件)。
通过消去反应制备Ⅰ的化学方程式为(注明反应条件)。
(3)Ⅱ与过量
在酸催化下发生酯化反应,生成的有机物的结构简式为。
(4)在一定条件下,化合物V能与
发生类似反应②的反应,生成两种化合物(互为同分
异构体),请写出其中任意一种化合物的结构简式:。
(5)与
类似,
也能被固定和利用。在一定条件下,
、 和
三者发生反
和
三者发生反
应(苯环不参与反应),生成化合物Ⅵ和Ⅶ,其分子式均为
,且都能发生银镜反应.下
列关于Ⅵ和Ⅶ的说法正确的有(双选,填字母)。
| A. | 都属于芳香烃衍生物 | B. | 都能使溴的四氯化碳溶液褪色 |
| C. | 都能与 反应放出 | D. | 1 Ⅵ或Ⅶ最多能与4 发生加成反应 |
本题包括A、B两小题,分别对应于"物质结构与性质"和"实验化学"两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用
与水反应生成乙炔。
(1)
中
与
互为等电子体,
的电子式可表示为;1
中含有的
键数目为。
(2)将乙炔通入
溶液生成
红棕色沉淀。
基态核外电子排布式为。
(3)乙炔与氢氰酸反应可得丙烯腈
。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
(4)
晶体的晶胞结构与
晶体相似(如图所示),但
晶体中含有的中哑铃形
的存在,使晶胞沿一个方向拉长。
晶体中1个
周围距离最近的
数目为。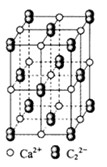
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。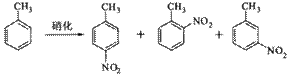
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体
为催化剂(可循环使用),在
溶液中,加入乙酸酐(有脱水作用),45
反应1h 。反应结束后,过滤,滤液分别用5%
,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于层(填"上"或'下");放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
| n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
| 浓
|
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
| 1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
|
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
| 0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
| 0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
| 0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
① 催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为。
催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是。
③与浓硫酸催化甲苯硝化相比,
催化甲苯硝化的优点有、。
以水氯镁石(主要成分为 )为原料生产碱式碳酸镁的主要流程如下

(l)预氨化过程中有
沉淀生成,已知常温下
的
,若溶液中
,则溶液中
=。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为。
(3)高温煅烧碱式碳酸镁得到
。取碱式碳酸镁4.66
,高温煅烧至恒重,得到固体2.00
和标准状况下
0.896
,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有
,则产品中镁的质量分数(填 "升高"、"降低"或"不变")。