关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为 。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________ 。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 |
C—H |
C=C |
C—C |
H—H |
| 键能/kJ·mol-1 |
414.4 |
615.3 |
347.4 |
435.3 |
试计算该反应的反应热___________________________
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为 。
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为 ;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为 ;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为___________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的
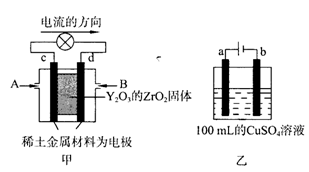
①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
(1)某可逆反应在不同条件下的反应历程分别为 、
、 ,如图所示。
,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中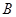 历程表明此反应采用的条件为 (选填序号)。
历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应: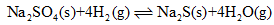
该反应的平衡常数表达式为 。
已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀。
①电解质溶液可选用(填序号) 。
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式 。
(1)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛地开发和应用前景。反应:
① 下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1__________0(选填“>”“=”或“<”),根据该反应特点,此反应自发进行的条件是____________(选填“高温”“低温”或“任何温度”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___________。
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度见下表。
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正__________v逆(选填“>”“<”或“=”)
②若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol·L-1,则该时间内反应速率v(CH3OH)=_____________。
(3)已知:
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;当溶液的pH=4时,则此溶液中Fe3+的物质的量浓度是_____________。
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
| 阳离子 |
K+ |
Cu2+ |
Fe3+ |
Al3+ |
Fe2+ |
| 阴离子 |
Cl- |
CO32- |
NO |
SO42- |
SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是 。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式__________。
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________(写离子符号)。
(5)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。