(1)下列7种固态物质:P4(白磷)、NH4Cl、Ca(OH)2、NaF、CO2、金刚石,回答下列问题(填写化学式或名称):[来源*:%z#zstep.^co&m]
①熔化时不需要破坏化学键的是___ _____,熔化时需要破坏共价键的是_____ ___;
②晶体中既有离子键又有共价键的是_____ ___。
③P4(白磷)、SiO2、NaF、CO2四种晶体熔点由高到低的顺序为_____ ___。
(2)某元素最高正化合价为+6,其最低负价为_____ ___。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为____ ____。
(11分) 铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,同答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。(填序号)
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴滴加1mol L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为 ,所形成该分散系的微粒粒度范围是 。
L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为 ,所形成该分散系的微粒粒度范围是 。
(3)电子工业需用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路极。请写出FeCl3溶液与铜反应的离子方程式 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水,需要用到的一组试剂是_____________。
A.①②④ B.①③④⑥C.②④⑤D.①④⑥
(4)高铁酸钠(Na2FeO4)是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3X+4NaOH=2Na2FeO4+3NaCl+5H2O,则X的化学式为 。
②高铁酸钠在水中可以发生如下反应:4FeO4 +10H2O==4Fe(OH)3+8OH
+10H2O==4Fe(OH)3+8OH +3O2↑。由此看来,高铁酸钠能够杀菌消毒是因为它具有___________性,而能够除去水中悬浮物是因为 。
+3O2↑。由此看来,高铁酸钠能够杀菌消毒是因为它具有___________性,而能够除去水中悬浮物是因为 。
③下列物质能用作净水剂的有___________。
a.KAl(SO4)2 l2H2O
l2H2O
b.聚合硫酸铁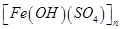
c.ClO2
d.“84”消毒液
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示: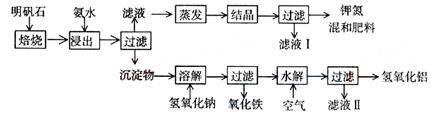
根据上述图示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出。
配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有251.28g氨)__________mL,用规格为___________mL量筒量取。
(2)氨水浸出后得到固体混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+。检验NH4+的方法是: 。
(3)写出沉淀物中所有物质的化学式 。
(4)滤液I的成分是水和______________。
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,请完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
②___________、__________、_________(依次填写实验操作名称)。
③冷却、称重。
(6)若试样为mg,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为: mol(用含有m、n的代数式表示)。
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2﹣、SO42﹣、SiO32﹣、CO32﹣、Cl﹣中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
(1)肯定不存在的离子是 .
(2)写出步骤②中生成沉淀和气体的反应的离子方程式: ; 。
(3)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣? (填“有”或“无”).
(1)实验室中可用KClO3和浓HCl反应制取氯气,写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目 ;该反应中,氧化产物是 ,还原产物是 ,氧化产物与还原产物的物质的量之比是 。
(2)化学镀镍的溶液中含有Ni2+和H2PO2-在酸性条件下发生如下反应,请配平该反应。
Ni2++ H2PO2-+ → Ni++ H2PO3-+
在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生反应:2SO2+O2 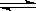 2SO3,当此反应进行到一定程度时,就达到化学平衡状态。若该容器中维持温度不变,令a、b、c分别代表初始时SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同。填写下列空白:
2SO3,当此反应进行到一定程度时,就达到化学平衡状态。若该容器中维持温度不变,令a、b、c分别代表初始时SO2、O2和SO3的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的体积分数仍跟上述平衡时完全相同。填写下列空白:
(1)若a = 0.5mol,则b = 。
(2)a、b、c取值必须满足的一般条件是(用两个方程式表示,其中一个只含a、c,另一个只含b、c)