化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
Ⅰ.一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应2HI H2+I2,H2物质的量随时间的变化如图所示。0~2 min内 的平均反应速率v(HI)=_________。该温度下,H2(g)+I2(g)
H2+I2,H2物质的量随时间的变化如图所示。0~2 min内 的平均反应速率v(HI)=_________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=_____。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
2HI(g)的平衡常数K=_____。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
Ⅱ.常温下,将pH=3的盐酸a L分别与下列三种溶液混合,
结果溶液均呈中性。
①浓度为1.0 ×l0-3 mol.L-1的氨水b L;
②c(OH-)=1.0×10-3mol.L-l的氨水c L;
③c(OH-)=1.0×10-3 mol ·L-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是: 。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。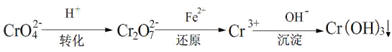
(1)转化过程中存在平衡2CrO42- + 2H+ Cr2O72- + H2O能说明反应到达平衡状态的是 。
Cr2O72- + H2O能说明反应到达平衡状态的是 。
| A.CrO42-和Cr2O72-的浓度相同 | B.2ν(Cr2O72-)=ν(CrO42-) |
| C.溶液的pH值保持不变 | D.溶液颜色保持不变 |
(2)若1L转化后所得溶液中含铬元素质量为28.6g,CrO42-有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。
①转化后所得溶液中c(Cr2O72-)= 。
②已知:常温下该反应的平衡常数K=1014,上述转化后所得溶液的pH为 。
(3)若常温下Ksp(Cr(OH)3) =10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(A)下列有机实验操作或叙述,正确的是_______(填写代号)
①能使酸性高锰酸钾溶液褪色的烃,分子中一定含有碳碳双键或者碳碳三键
②乙酸乙酯中含有少量乙酸可用饱和的Na0H溶液除去
③蔗糖水溶解时应用弄 作催化剂
作催化剂
④在鸡蛋清溶液中滴入饱和的 溶液后有沉淀析出
溶液后有沉淀析出
⑤银镜反应的实质是Ag+把—CHO氧化成—COOH
⑥实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
(B)25℃~101kPa时,mg仅含三种元素的有机物在足量的 中充分燃烧。其燃烧产物通入过量的
中充分燃烧。其燃烧产物通入过量的 固体,固体质量增加了mg。
固体,固体质量增加了mg。
①下列物质中不能满足上述结果的是()
A.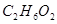 B.
B.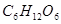 C.
C. D.
D.
②A是符合上述条件且相对分子质量最小的有机物,则A的电子式_______。
A中所有原子是否共面_______。(填‘是’或‘否’)
(C)用系统命名法命名下列物质 ①____________;
①____________;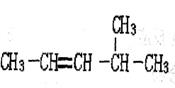 ②__________;
②__________;
(14分)研究表明:丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图1表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。写出230℃该反应的热化学方程式:_______________。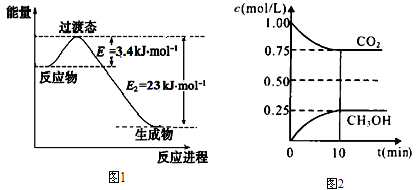
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示。
①能说明该反应已经达到平衡状态的是_______________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②计算该温度下此反应的平衡常数K=________。(保留两位有效数字)。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(3)某甲醇燃料电池原理如图1所示。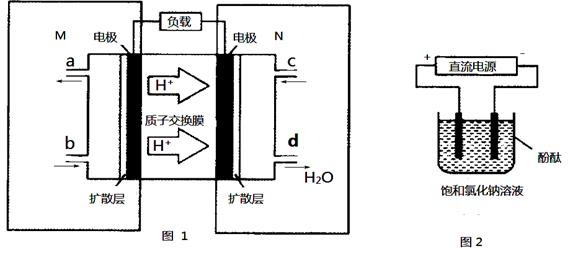
①M区发生反应的电极反应式为_________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:。假设溶液体积为300 mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为_______(忽略溶液体积变化)。
(12分)金属铜及其化合物在生产和生活中都有重要的应用。
(1)写出铜原子价电子层的电子排布式______________。第四周期基态原子最外层电子数与铜相同的元素有_____________种。
(2)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,继续滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,然后向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀。
①SO42-中S原子的杂化方式为________________________。
②NH3分子内的H-N-H键角______(填“大于”“等于”或“小于”)H2O分子内的H-O-H键角。
(3)如图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为______________。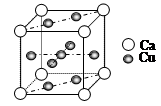
(4)CuO受热易分解为Cu2O和O2,请从铜的原子结构角度来说明CuO受热易分解的原因:__________________。
PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
K+ |
Na+ |
NH4+ |
SO42- |
NO3- |
Cl- |
| 浓度/mol•L-1 |
4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据计算PM2.5试样的pH。
(2)NOx汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
则N2和O2反应生成NO的热化学反应方程式为_________________。
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: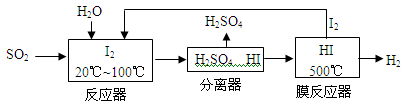
①用离子方程式表示反应器中发生的反应:_________________。
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式_________________。
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是________(填序号)。
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O(g) 2H2+O2
2H2+O2
C.太阳光催化分解水制氢
2H2O 2H2↑+O2↑
2H2↑+O2↑
D天然气制氢:CH4+H2O(g) CO+3H2
CO+3H2
②CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示。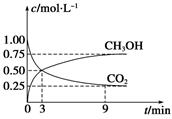
从3 min到9 min,v(H2)=_______mol·L-1·min-1。
③能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
| 温度/℃ |
0 |
100 |
200 |
300 |
400 |
| 平衡常数 |
667 |
13 |
1.9×10-2 |
2.4×10-4 |
1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题。
(1)元素D在周期表中的位置________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____。
(3)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有________。用电子式表示当C、D按1:1所组成化合物的形成过程________。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________________________________。
(5)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:_______________________________________________________。