从H+、Na+、Cu2+、Ba2+、Cl—、SO42—离子中,选出恰当的离子组成一种电解质,将电解质溶液按下列要求进行电解(均是惰性电极):
(1)电解时电解质含量减小,水量不变,则所采用的电解质是 ;
(2)电解时电解质的质量保持不变,水量减小,则所采用的电解质是 ;
(3)电解时电解质和水的质量都发生变化,则所采用的电解质是 ;
为防止碘缺乏病,通常在食盐中添加少量碘酸钾(KIO3),碘酸钾和碘化钾在酸性溶液中能发生下列反应。请标出方程式中电子转移的方向与数目,
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
此反应中,氧化剂是,还原剂是。氧化剂和还原剂的物质的量之比是。
新制氯水中含有多种成分:,氯水应存放在瓶中保存。将紫色石蕊试液滴入氯水中,溶液显红色,起作用的成分是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分是 ;往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是 ;
根据下列几种粒子的结构示意图,回答问题:(填编号)
(1)其中属于阴离子的是,
(2)属于金属元素的是,
(3)具有相似化学性质的是。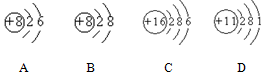
有以下几种物质①干燥的食盐晶体②液态氯化氢③铜④蔗糖⑤冰醋酸⑥KNO3溶液填空回答:(填序号)
(1)以上物质能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中属于非电解质的是
(4)以上物质中溶于水后水溶液能导电的是
(1)1.5molH2SO4的质量是________,其中含有______mol H,含有_______g氧元素。
(2)9.03×1023个氨分子含___________摩尔氨分子,____________摩尔氢原子,
____________摩尔质子,________________个电子。
(3)__________mol CO2中含有3g碳。标况下,_________L CO2中含有0.25mol 氧原子,____________mol CO2中含有3.01×1023个CO2分子,它的质量是______________。