某有机物X(C12H14O7)的分子中含有多种官能团,其结构简式为:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化: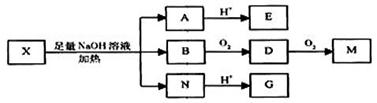
已知1)向X、E的水溶液中滴入FeCl3溶液均发生显色反应; 2)E的核磁共振谱图中只有两个峰,面积比为1:2; 3)G、M(C2H2O4)都能与NaHCO3溶液反应。
(1)写出X的结构简式为 。
(2)1molX与NaOH溶液反应时,消耗 mol NaOH。
(3)E的结构简式是 ;B的命名为_____________________
①写出B转化成D的化学方程式:___________ __________
②写出A溶液与CO2反应的离子方程式:________________ _________。
H与G互为同分异构体,H的分子中只含有醛基、羧基、羟基三种官能团,且同一个碳原子上不 能同 时连有两个羟基,则H的分子结构有______种.
为测定 FeO 和 Fe2O3 固体混合物中 Fe元素的含量,可用氢气还原一定质量的此混合物并测定生成水的质量的方法来完成。若在实验室中选用下列实验装置来实现上述目的(图中夹持装置已略去,部分装置可重复使用)。请填空:
⑴仪器X的名称是。
⑵写出A中发生反应的离子方程式,
实验前如何检验装置A的气密性。
⑶下图所示装置中与A装置具有相同作用的是(填装置编号)。
⑷按正确的实验设计,所连接的装置顺序为:A→C→→→。
⑸若FeO和Fe2O3混合物的质量为 ag,反应完全后生成水的质量为 b g,则混合物中
Fe元素的质量分数为(用含字母的数学式表示)。
氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g)
4NO(g) + 6H2O(g)
⑴①该反应的熵变△S0(填“>”、“<”或“=”)。
②升高温度,反应的平衡常数K值减小,则该反应的焓变△H0(填“>”、“<”或“=”)。
⑵若其他条件不变,下列关系图错误的是(选填序号)。
⑶在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
| 时间/浓度/(mol·L-1) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第 2 min |
3.2 |
0.8 |
1.2 |
|
| 第 4 min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第 6 min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第 2 min 到第 4 min 时,反应速率υ(O2) =;
②反应在第 2 min 时改变了条件,改变的条件可能是。
该条件下,反应的平衡常数K=(只写计算结果,不标单位)。
氢氧碱性燃料电池是一种高效、环境友好的新型电池,在航空航天、潜艇和汽车等领域得到了广泛的应用。
⑴写出该电池两极的电极反应式。
负极:,
正极:。
⑵ 用该燃料电池做电源,以石墨为电极电解足量的饱和食盐水,请回答下列问题:
①写出电解饱和食盐水发生反应的化学方程式:。
②每生成 0.1 mol 阳极产物,燃料电池中消耗氢气的物质的量为。
向滴有酚酞的氢氧化钠溶液中滴加过氧化氢,溶液的红色褪去,有同学对此提出了两种假设:
假设一:过氧化氢表现出酸性,中和了原有的氢氧化钠
假设二:过氧化氢表现了
请通过实验证明是哪一种假设成立。
| 实验 |
现象 |
结论 |
| 向已褪色的溶液中继续加入足量的 溶液(填化学式) |
若溶液; |
则假设成立 |
若溶液; |
则假设成立 |
制取氨气并完成喷泉实验(图中夹持装置均已略去)。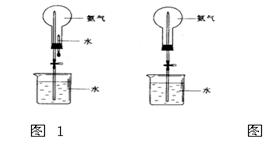
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法,要得到干燥的氨气可选用做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。该实验利用了氨气
的性质。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。