A、B、C、D、E、F、G、H、和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使 湿润的石蕊试纸变色;
②A和I相遇产生白烟
③B和E都能使品红溶液褪色
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟
⑤ 将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥ C和D相遇生成红棕色气体;
⑦ G在D中燃烧可以产生E和H2O
⑧ 将B和H 在瓶中混合后于光亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是 ,②中白烟的化学式是 ;
(2) ④中发生反应的化学方程式是 ;
(3)⑤中发生反应的化学方程式是 ;
(4)C的化学式是 ,D的电子式是 ;
(5) ⑦中发生反应的化学方程式是 ;
(6) H的结构式是
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ 。
(2)写出①处发生反应的离子方程式 。写出③处发生反应的化学方程式 。
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
(1)请将 5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质,被还原的元素是 。
。
(3)反应中1 mol氧化剂(填“得到”或“失去”)mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
25℃时,如果取0.5mol/LHA溶液与0.5mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得pH=10。试回答以下问题:
(1)混合溶液中由水电离出的c(H+)_______0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
(2)用方程式解释为什么混合后溶液的pH﹥7
(3)求出混合溶液中下列算式的计算结果(填具体数字):
c(A-)+c(HA)=mol/L; c(OH-)-c(HA)=mol/L。
(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4②CH3COONH4③(NH4)2Fe(SO4)2④NH4Cl的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)
4C(g) H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量②加压③升温④使用催化剂
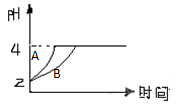
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)