用18.4mol·L-1的浓硫酸,配制 100 ml 1.0 mol·L-1的稀硫酸,请回答以下问题:
(1)需要18.4mol·L-1的浓硫酸 ml。
(2)下列哪组仪器在配制时不需要用到 ( )
①托盘天平 ②分液漏斗 ③250ml容量瓶 ④烧杯 ⑤胶头滴管
⑥量筒 ⑦玻璃棒⑧铁架台(带铁夹) ⑨100ml容量瓶
A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.①②③⑧ D.③④⑤⑥
(3)下列实验步骤中,正确的操作顺序应该是:
A 用量筒量取浓硫酸,缓缓倒入装有约50ml蒸馏水的烧杯里,并用玻璃棒搅拌。
B 用约30ml蒸馏水,分出三次洗涤烧杯和玻璃棒,将每次洗涤液都倒入容量瓶中;
C 将稀释后的硫酸小心地倒入容量瓶中;
D.检查100ml容量瓶瓶口是否有漏液现象;
E.将蒸馏水直接加入容量瓶,至液面接近刻度线1——2cm处;
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液;
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切;
(4)进行A步骤操作的时候,应该选用
①10 ml量筒 ②50 ml量筒 ③5000 ml量筒 ④1000 ml量筒
(5)进行A步操作后,必须 后,才能进行C步操作。
下图是一套制取并验证氯气部分化学性质的实验装置。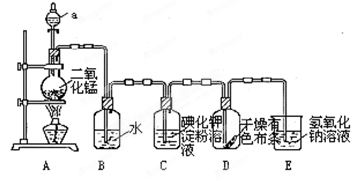
回答下列问题:反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑
MnCl2+2H2O+ Cl2↑
(1)装置A中,仪器a盛有的试剂为____。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为____色。
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
____________。
(5)装置E的作用是________。并写出该反应的化学方程式:。
(6)写出氯气与石灰乳制取漂白粉的化学方程式: ____________;
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: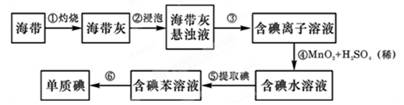
请填写下列空白:
(1)步骤⑤的操作名称是用到的主要仪器是:
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
( 14分)为了探究浓度对硫酸氧化性的影响,某学习小组进行了以下探究活动:
[探究一]
称取无锈铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(1)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+,请选择下列试剂,设计简单的实验方案(简述操作过程、现象和结论)。
(供选用试剂:.KSCN溶液,氯水,铁粉,.浓氨水,酸性KMnO4溶液。)
(2)乙同学为了测定气体Y中SO2的含量,设计如下三种方案:
方案I:取672mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。
方案II:向VmL c mol·L-1酸性高猛酸钾溶液中缓慢通入Y气体aL(标准状况),溶液恰好完全褪色。
方案III:取VL(标准状况)气体Y缓慢通入足量的氢氧化钡溶液中,充分反应后,过滤、洗涤、烘干,称得固体质量为mg。
其中不合理的方案是,理由是。
[探究二]
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和CO2
气体。为此设计了下列探究实验装置(图中夹持装置已省略)。
(3)装置A中试剂的作用是。
(4)简述确认气体Y中含有CO2的实验现象:。
(5)有同学根据“F干燥管无水硫酸铜是否变蓝色”确认Y气体中是否有氢气,你认为是否可靠?(填“可靠”或“不可靠”),简述理由:。
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用如图装置(夹持装置略)对其进行探究实验。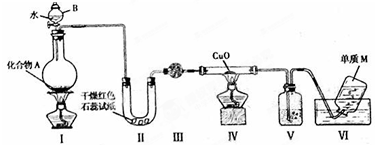
(1)仪器B的名称是________。
(2)试验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成,则Ⅲ中的试剂为_________;Ⅳ发生反应的化学方程式为________;Ⅴ中的试剂为_____________。
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ—Ⅲ—Ⅳ—Ⅱ—Ⅴ—Ⅵ,此时Ⅱ中现象为________,原因是__________________。
(4)经上述反应,2.5g化合物A理论上可得0.56L(标准状况)M;则A的化学式为________________。
如图甲、乙是电化学实验装置。
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________;
②乙中总反应的离子方程式为___________________________________________;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为_______________________________________________________。
(2)若甲 、乙两烧杯中均盛有CuSO4溶液。
、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为___________________________________________;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入______________(填写物质的化学式)_______________g。