在恒温恒压下,向密闭容器中充入4mol A和2 mol B,发生如下反应:2A(g)+B(g) 2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
2C(g) ΔH<0。2min后,反应达到平衡,生成C为1.6mol。则下列分析正确的是
A.若反应开始时容器体积为2L,则v(C)=0.4mol•L-1•min-1
B.若该反应在恒温恒容下进行,放出热量将增加
C.若2min后,向容器中再投入等物质的量A、C,B的转化率不变
D.若在恒压绝热条件下反应,平衡后n(C)<1.6mol
不需要化学变化就能够从海水中获得的物质是
| A.氯、溴、碘 | B.钠、镁、铝 | C.烧碱、氢气 | D.氯化钠 |
合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入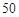 mL bmol·L
mL bmol·L 的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
| A.若金属有剩余,在溶液中再滴入硫酸后,剩余金属一定又开始溶解 |
B.若金属全部溶解,则溶液中一定含有Fe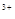 |
C.若金属全部溶解,且产生 mL气体(标准状况),则b mL气体(标准状况),则b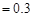 |
D.当溶液中金属离子只有Fe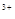 、Cu 、Cu 时,则a与b的关系为:b≥ 时,则a与b的关系为:b≥ (1 (1 a/3) a/3) |
下列反应的离子方程式书写正确的是( )
| A.将等物质的量的Ba(OH)2与明矾投入足量水中: 3Ba 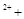 6OH 6OH 2A1 2A1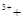 3SO 3SO → 3BaSO4↓ → 3BaSO4↓ 2A1(OH)3↓ 2A1(OH)3↓ |
B.把Fe(OH)3溶于氢氟酸:Fe(OH)3 3H 3H → Fe → Fe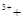 3H2O 3H2O |
C.向H O中投入Na2O2固体:2H O中投入Na2O2固体:2H O O 2Na2O2 → 4Na 2Na2O2 → 4Na 4OH 4OH 18O2↑ 18O2↑ |
D.在苯酚钠溶液中通入少量的二氧化碳气体:C6H5O CO2 CO2 H2O → C6H5OH H2O → C6H5OH HCO HCO |
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe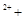 H2O2
H2O2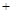 2H
2H → 2Fe
→ 2Fe 2H2O 2Fe
2H2O 2Fe H2O2 → 2Fe
H2O2 → 2Fe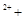 O2↑
O2↑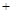 2H
2H
下列说法正确的是( )
A.H2O2的氧化性比Fe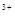 强,其还原性比Fe 强,其还原性比Fe 弱 弱 |
| B.在H2O2分解过程中,溶液的pH逐渐下降 |
C.在H2O2分解过程中,Fe 和Fe 和Fe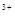 的总量保持不变 的总量保持不变 |
D.H2O2生产过程要严格避免混入Fe |
水是最宝贵的资源之一。下列表述正确的是( )
A.H2O的电子式为 |
B.4℃时,纯水的pH |
| C.D216O中,质量数之和是质子数之和的两倍 |
| D.273K、101kPa,水分子间的平均距离d:d(气态)>d(液态)>d(固态) |