要分离下列五组混合物,分别用什么方法:
①饱和食盐水与沙子 ②水和汽油的混合物
③CCl4与甲苯的混合物 (已知CCl4与甲苯互溶,沸点分别为76.75℃和110.8℃ )
④ 食盐和水 ⑤ 氯化钠和硝酸钾
某溶液含有下表离子中的几种(不考虑水的电离及离子的水解)。溶液中阴离子物质的量为0.2mol,阳离子物质的量为0.3mol,阳离子只有两种。
| 阳离子 |
Ba2+ NH4+ Fe3+Al3+ Fe2+ |
| 阴离子 |
OH-CO32-Cl-SO32- SO42- |
①若向原溶液中加入过量稀盐酸,无气体生成,得到溶液A。
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,溶液中析出白色沉淀。过滤,得滤液B。
③往B中加入过量NaOH溶液并加热,有4.48L刺激性气味气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成。过滤,得滤液C,此过程中沉淀的量不减少。
④若向原溶液中加入稀HNO3,再加足量BaCl2,有46.6g白色沉淀生成。
根据上述实验回 答下列问题。
答下列问题。
(1)写出步骤③中产生红褐色沉淀的离子方程式。
(2)原溶液中一定不存在的阴离子是。
(3)原溶液中的物质在空气中很容易被氧化,设计简单实验予以证明。简述操作步骤及可能观察到的实验现象。
(4)若原溶液由一 种盐溶解于水制得,则该盐的化学式为。
种盐溶解于水制得,则该盐的化学式为。
(5)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则这两种盐的
化学式为、,其物质的量之比为。实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,原因是。
A、B、C、D、E均为中学化学常见的10电子粒子。已知,M(A)>M(B),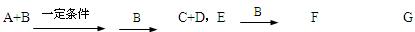
C是一种重要的化工原料。下图表示在1L的密闭容器中,一定条件下X、Y、C三种气体因发生反应而导致的物质的量随时间的变化情况。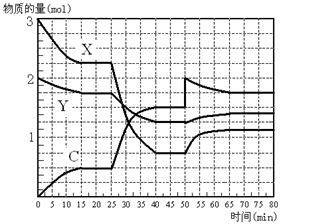
回答下列问题。
(1)写出B的电子式。
(2)写出F G的离子方程式。
G的离子方程式。
(3)根据题图写出相关的化学方程式。(用化学式表示)
(4)下表为一定条件下平衡混合物中C的体积分数(C%)。分析数据可知,表中a的取值范围是。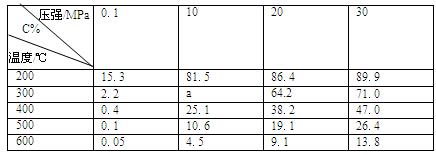
(5)根据题图和题表分析,25 min ~ 40 min内曲线发生变化的原因可能是(填选项代号,下同);50 min ~ 65 min曲线发生变化的原因可能是。
A.降低温度B.增加C的物质的量 C.加了催化剂D.缩小容器体积
(6)工业上合成C的温度一般选择在500℃左右,主要原因是。
用乙醇制取乙二醇(HOCH2—CH2OH),需要经过3个阶段,依次写出反应的化学方程式,并注明反应类型:
(1)反应方程式,反应类型。
(2)反应方程式 ,反应类型。
,反应类型。
(3)反应方程式,反应类型。
(共20分)
Ⅰ:现有CH4、C2H4、C2H2、C2H6、C3H8五种有机物,回答下列问题:
⑴质量相同时:在相同状况下体积最大的是__ ___,完全燃烧时消耗O2的量最多的是__ _,
⑵同温同压同体积时,五种物质完全燃烧消耗O2的量最多的是__
Ⅱ:有机化学中的反应类型较多,将下列反应归类(填序号)。
①乙苯的制备:
②乙 烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色
烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应⑦溴乙烷和氢氧化钠溶液共热
⑧由甲苯制取TNT ⑨往苯酚钠溶液中通入CO2溶液中
(1)其中属于取代反应的是;属于氧化反应的是;
属加成反应的是属于聚合反应的是
(2)写出⑦、⑧、⑨的化学方程式
⑦
⑧
⑨
(1)在下列物质中是同系 物的有;互为同分异构体的有;
物的有;互为同分异构体的有;
互为同素异形体的有;互为同位素的有;属于同一物质的是:
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)D (6)T
(3)白磷 (4)红磷 (5)D (6)T
(7) 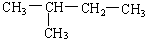 (8)
(8) 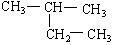
(9)CH2 = CH-CH3(10) 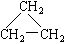 (11)2,2—二甲基丁烷
(11)2,2—二甲基丁烷
(2)、把一端弯成螺旋状的铜丝放在酒精灯火焰加热,看到铜丝表面变_黑,再迅速插入盛乙醇的试管中,看到铜丝 表面 __________;反复多次后,试管中生成有特殊气味的物质,反应的化学方程式为 _____;乙醇所含的官能团的名称______
表面 __________;反复多次后,试管中生成有特殊气味的物质,反应的化学方程式为 _____;乙醇所含的官能团的名称______