(1)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中, B试管置于冷水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: ;当 ,证明达到滴定终点。
③计算:重复上述操作2次,记录实验数据如下表。则消耗KMnO4溶液的平均体积为 mL,此样品的纯度为 。(已知H2C2O4的相对分子质量为90)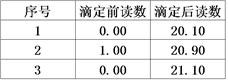
④误差分析:下列操作会导致测定结果偏高的是 。
| A.未用标准浓度的酸性KMnO4溶液润洗滴定管 | B.滴定前锥形瓶有少量水 |
| C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 | D.不小心将少量酸性KMnO4溶液滴在锥形瓶外 |
E.观察读数时,滴定前仰视,滴定后俯视
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为。
⑵铜片周围溶液会出现的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为mo1;
②该段时间内用硫酸铜表示的平均反应速率为
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,右图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是(填序号,下同);
① o→a段不产生产生H2是室温过低,反应难以发生。
② b → c段产生H2较快可能是反应放热,温度升高,加快了反应
③ c以后,产生H2速率逐渐下降原因可能是铝片趋于消耗完全
(2)在b到c这段时间内,收集到氢气VL(标准状况),则这段时间内用硫酸表示的平均速率为mol/(L·s)(假设反应前后溶液体积不变)。
(3)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③将铝片换成铝粉 ④增加硫酸的浓度至18 mol/L ⑤加CH3COONa固体; ⑥加入少量Na2SO4溶液
(5)催化剂会影响反应速率,请根据①反应写出FeCl3催化H2O2分解的另一反应原理(用离子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;②;
关于反应热请回答如下问题:
(1)向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应为△H1、△H2、△H3,则三者由小到大顺序为。
(2) 实验测得,向200mL1mol/L的NaOH溶液中加入稀醋酸恰好反应放出Q kJ的热量,请写出热化学反应方程式:_________________________。
(3)已知反应CH3—CH3(g)―→CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 |
C—H |
C=C |
C—C |
H—H |
| 键能/kJ·mol-1 |
414.4 |
615.3 |
347.4 |
435.3 |
试计算该反应的反应热___________________________
(4)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g)△H=-92.4kJ/mol
2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为。
(14分)Ⅰ、某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%。
(1) A与溴的四氯化碳溶液反应的化学方程式为;
(2)已知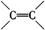
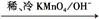

请写出A与稀、冷的KMnO4溶液在碱性条件下反应所得产物与足量乙酸反应的化学方程式 ;
(3)在一定条件下,由A聚合得到的高分子化合物的结构简式为 。
(4) A与氢气完全加成后的一氯代物共有 种。
Ⅱ、用如图所示装置制取乙酸乙酯,请回答以下问题。
(5)在试管中配制一定比例的乙醇、乙酸和浓H2SO4的混合液的方法是_______
(6)末端干燥管的作用是_______________。
(7)实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现石蕊层为三层环,由上而下是颜色为_________________。
已知酮类化合物可以和氰化氢发生加成反应。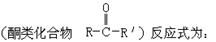
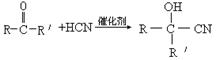
上述反应的生成物在一定条件下可发生水解生成羧酸: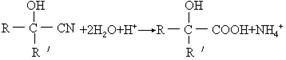
依上述反应规律,按照提示的反应类型,写出用丙酮为原料经5步合成聚甲基丙烯酸甲酯的反应方程式,并注明所缺的反应类型(其它必要的原料可任意选择):
(1)_________,______________________________________________;
(2)水解,______________________________________________;。
(3)_________,______________________________________________;
(4)消去,______________________________________________;
(5)_________,______________________________________________。