在稀氨水中存在平衡:NH3+H2O NH
NH +OH-,如进行下列操作,则NH3、NH
+OH-,如进行下列操作,则NH3、NH 、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
、H+、OH-浓度如何变化?请用“增大”“减小”“不变”填写。
(1)通适量HCl气体时,c (NH3) ,c (H+) 。
(2)加入少量NaOH固体时,c(NH ) ,c (OH-) 。
) ,c (OH-) 。
(3)加入NH4Cl晶体时,c (NH ) ,c (OH-) 。
) ,c (OH-) 。
如右图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
(1)打开K2 ,合并K1 ,若所盛溶液为CuSO4溶液:则A为极,A极的电极反应式为。若所盛溶液为KCl溶液:则B极的电极反应式为, K+移向极(填A、B)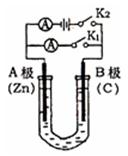
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,则:①A电极附近可观察到的现象是。
②B电极上的电极反应式为,总反应化学方程式是 。
。
③反应一段时间后打开K2 , 若忽略溶液的体积变化和气体的溶解,B极产生气体的体积(标准状况)为11.2mL, 将溶液充分混合,溶液的pH约为。若要使电解质溶液恢复到原状态,需向U形管内加入或通入一定量的。
(3)如要用电解方法精炼粗铜,打开K1,合并K2,电解液选用CuSO4溶液,则A电极的材料应换成是,电极反应式是,反应一段时间后电解质溶液中Cu2+浓度(填“增大”、“减小”、“不变”)。
已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是________
某反应中反应物与生成物有: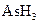 、
、 、
、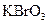 、
、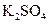 、
、 、
、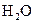 和一种未知物质X。
和一种未知物质X。
 (1)已知
(1)已知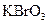 在反应中得到电子,则该反应的还原剂是。
在反应中得到电子,则该反应的还原剂是。 (2)已知0.2mol
(2)已知0.2mol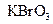 在反应中得到1mol电子生成X,则X的化学式为。
在反应中得到1mol电子生成X,则X的化学式为。 (3)根据上述反应可推知。
(3)根据上述反应可推知。 a.氧化性:
a.氧化性: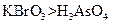 b.氧化性:
b.氧化性: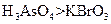
 c.还原性:
c.还原性: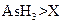 d.还原性:
d.还原性:
 (4写出该反应的化学方程
(4写出该反应的化学方程 式,并标出电子转移的方向
式,并标出电子转移的方向 和数目:
和数目:

 (9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。
(9分)已知NH3与CuO在加热条件下可生成N2,方程式为2NH3+3CuO3Cu+N2+3H2O。纯氮气跟镁在高温下反应可得到氮化镁,氮化镁遇水反应可生成氢氧化镁和氨气。

(1)下面是化学课外小组的同学提出的实验室制备氨气的几种方案:
| A.硫酸铵固体与消石灰共热 | B.浓氨水逐滴加到新制的生石灰中 |
| C.在一定条件下,氮气与氢气化合 | D.加热分解氯化铵固体 |
你认为其中较简单易行的方案有________________(填字母);其反应的化学方程式为:___________________________,___________________________。
(2)该小组同学设计的制备氮化镁的实验方案如下图 (夹持及加热仪器没有画出),且在实验前系统内的空气均已排尽。
①该实验完成后,能否得到纯净的氮化镁________(填“能”或“不能”);简述理由____________________________________________________。
②装置C的作用是___________________________________.
(12分)Ⅰ.从下列各组反应对比,判断哪种微粒的氧化性最强。
(1)在氯气中Fe锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液FeCl2。则氯气分子、氢离子、氯离子中,__________具有氧化性,__________氧化性最强。请书写出以上各反应的化学方程式___________________________。
(2)已知在ⅣA族元素中,Pb2+和Sn4+的化合物较为稳定。
据此可判断PbO2具有较强的________性,SnCl2具有较强的________性;写出PbO2溶于盐酸的离子方程式____________________;写出SnCl2和FeCl3溶液混合的离子方程式_______________________________________
Ⅱ.氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40°C~50°C时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+===Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________。
(3)CuH溶解在稀盐酸中生成的气体是____________(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式: ______________________________。