(16分)某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下:
已知:
①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-:
②)TiOSO4水解的反应为:TiOSO4+(x+1)H2O=TiO2∙xH2O↓+H2SO4
请回答:
(1)步骤①所得滤渣的主要成分为__________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比_______。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是______________________。
(5)已知:FeCO3(s)  Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因__________。
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________。
(1)已知:O2 (g)= O2+ (g)+e- △H1=" +1175.7" kJ·mol-1
PtF6(g)+ e-= PtF6-(g)△H2=" -" 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6- (g)△H3="+482.2" kJ·mol-1
则反应:O2(g)+ PtF6 (g) = O2+PtF6(s)的△H="_____" kJ·mol-1。
如图为合成氨反应在使用相同的催化剂,不同温度和压强条件下进行反 应,初始时N2和H2的体积比为1:3时的平衡混合物中氨的体积分数: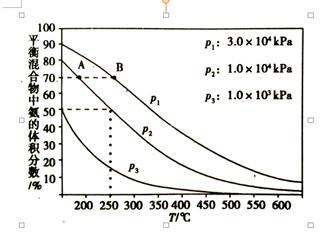
① 在一定的温度下,向体积不变的密闭容器中充入氮气和氢气发生上述反应,下列能说明反应达到平衡状态的是。
a.体系的压强保持不变b.混合气体的密度保持不变
c.N2和H2的体积比为1:3 d.混合气体的平均摩尔质量不变
②分别用vA(NH3)和vB(NH3)表示从反应开始到平衡状态A、B时的反应速率,则vA(NH3)vB(NH3)(填“>”、“<”或“=”),该反应的的平衡常数kAkB(填“>”、“<”或“=”),在250 ℃、1.0×104kPa下达到平衡,H2的转化率为%(计算结果保留小数点后一位);
(3)25℃时,将a mol NH4NO3溶于水,溶液呈酸性,原因(用离子方程式表示)。向该溶液中加入bL氨水后溶液呈中性,则所加氨水的浓度为mol/L(用含a、b的代数式表示,NH3·H2O的电离平衡常数为Kb=2×10-5)
(4)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。电镀一段时间后,装置Ⅰ中溶液的pH (填“变大”、“变小”或“不变”),a极电极反应方程式为;若电镀结束后,发现装置Ⅱ中阴极质量变化了25.6g(溶液中硫酸铜有剩余),则装置Ⅰ中理论上消耗甲烷L(标准状况下)。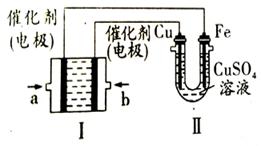
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下: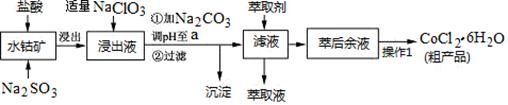
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式_____________________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______________。
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、__________和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。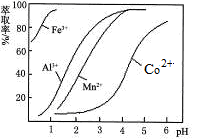
A.2.0~2.5B.3.0~3.5C.4.0~4.5D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
对-甲乙苯( )是一种重要的有机原料,用该物质可合成其他物质。
)是一种重要的有机原料,用该物质可合成其他物质。
已知:①1molD与足量钠反应可生成1mol氢气;
②D、E、F每种分子中均只含有一种含氧官能团。
③G是一种有机高分子化合物。
回答下列问题:
(1)对-甲乙苯的系统命名为_____________;A的结构简式为____________。
(2) A→B的反应类型为___________;F中含氧官能团的名称为____________。
(3)C在引发剂的作用下,可生成高分子化合物,该高分子化合物的链节为____________。
(4) 1molE和足量银氨溶液反应,生成沉淀的物质的量为___________。
(5) D+F→G的化学方程式为_____________________________________________。
(6)H比D相对分子质量小14,H的同分异构体能同时满足如下条件:①苯环上有两个取代基;②遇氯化铁溶液显紫色;③核磁共振氢谱为六组峰,且峰面积比为2:2:2:2:1:1,写出H的这种同分异构体的简式_________________。
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HA H++A- Ka(HA)=2.95×10-8
H++A- Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=;该反应的化学方程式为________________________________________。