(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
| A.明矾 | B.二氧化氯 | C.臭氧 | D.高铁酸钠( Na2FeO4) |
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式: 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| |
含锌废水水质 |
经处理后的水国家环保标准值 |
| Zn2+浓度/(mg·L-1) |
≤800 |
≤3.9 |
| pH |
1~5 |
6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×1017), (填“符合”或“不符合”)国家环保标准。
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的
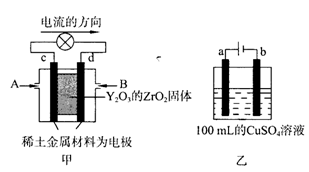
①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
(1)某可逆反应在不同条件下的反应历程分别为 、
、 ,如图所示。
,如图所示。
①据图判断该反应是 (填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”);
②其中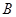 历程表明此反应采用的条件为 (选填序号)。
历程表明此反应采用的条件为 (选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应: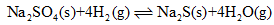
该反应的平衡常数表达式为 。
已知K1000℃ < K1200℃, 若降低体系温度,混合气体的平均相对分子质量将 (填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀。
①电解质溶液可选用(填序号) 。
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式 。
(1)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛地开发和应用前景。反应:
① 下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1__________0(选填“>”“=”或“<”),根据该反应特点,此反应自发进行的条件是____________(选填“高温”“低温”或“任何温度”)
②某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___________。
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度见下表。
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正__________v逆(选填“>”“<”或“=”)
②若其他条件不变,在T2℃反应10min后达到平衡,c(H2)=0.4mol·L-1,则该时间内反应速率v(CH3OH)=_____________。
(3)已知:
Al和FeO发生铝热反应的热化学方程式是 。
(4)已知:常温下,Ksp[Fe(OH)3]=4.0×10-38;当溶液的pH=4时,则此溶液中Fe3+的物质的量浓度是_____________。
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
| 阳离子 |
K+ |
Cu2+ |
Fe3+ |
Al3+ |
Fe2+ |
| 阴离子 |
Cl- |
CO32- |
NO |
SO42- |
SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是____________(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是 。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式__________。
(4)甲同学最终确定原溶液中所含阳离子是________,阴离子是________(写离子符号)。
(5)另取100 mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为________g。
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。
(1)请配平e处的化学反应方程式 KMnO4+
KMnO4+ HCl(浓)===
HCl(浓)=== KCl+
KCl+ MnCl2+
MnCl2+ Cl2↑+
Cl2↑+ H2O
H2O
(2)e处反应中发生氧化还原反应的氧化剂和还原剂的物质的量之比为 。
(3)b处的实验现象为 ,d处的离子方程式为 。
(4)c处反应的离子方程式为 ,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为________mol。
(5)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱?________(填“能”或“不能”),若能,其氧化性由强到弱的顺序是______________________。