(1)20℃时0.1 mol·L-1NaOH分别滴定0.1 mol·L-1HCl、0.1 mol·L-1CH3COOH的pH变化曲线如下。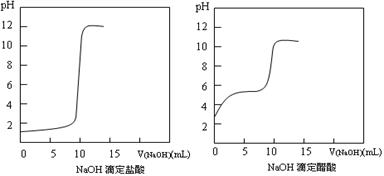
根据上述曲线回答下列问题:
①测得醋酸起点pH为3,则20℃时该浓度醋酸的电离度为 ;
②滴定开始后醋酸曲线变化比盐酸快的原因是 ;
(2)25 ℃时0.1 mol·L-1的H2R水溶液中,用氢氧化钠来调节溶液pH,得到含有H2R、HR-、R2-三种微粒的溶液。当c(Na+)=c(R2-)+c(HR-)+c(H2R)时溶液的溶质为 (填化学式)。
(3)下图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。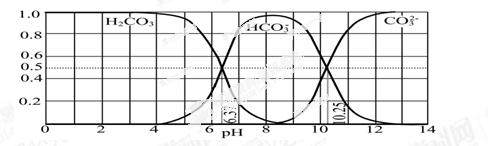
①下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
| 弱电解质 |
H2CO3 |
NH3·H2O |
| 电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c (NH4+)>c (CO32-)>c (HCO3-)>c (NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c (CO32-) + c (HCO3-) +c (H2CO3)=0.1 mol·L-1
D.c (NH4+)+ c (NH3·H2O)=2 c (CO32-) + 2c (HCO3-) +2 c (H2CO3)
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。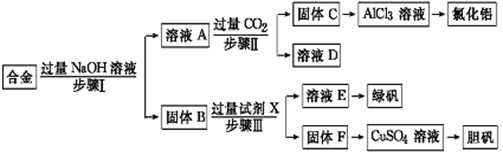
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。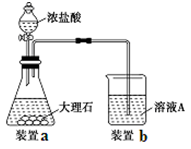
(4)用固体F制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示: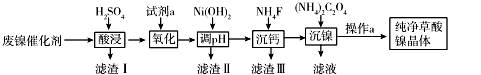
已知:①相关金属离子生成氢氧化物沉淀的pH如下表: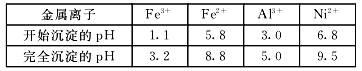
②KSP(CaF2) =1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
(1)请写出一种能提高酸浸速率的措施________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式 。
(3)pH的调控范围为 ,试用化学反应原理的相关知识解释滤渣Ⅱ的生成
(4)写出“沉镍”时反应的离子方程式 ,证明Ni2+已经沉淀完全的实验步骤及现象是 ,当Ca2+沉淀完全时,溶液中c(F-)>_____________(写出计算式即可)。
(5)操作a的内容是 。
肼(N2H4)与N2O4,是火箭发射中最常用的燃料与助燃剂。
(1)已知2N2H4(l)+ N2O4(l)= 3N2(g) +4H2O(l) △H=-1225KJ/mol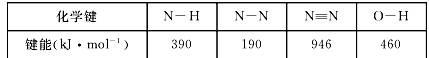
则使1 mol N2O4(l)完全分解成相应的原子时需要吸收的能量是 。
(2)800℃时,某密闭容器中存在如下反应:2NO2(g)  2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。
2NO(g) +O2(g) △H>0,若开始向容器中加入1 mol/L的NO2,反应过程中NO的产率随时间的变化如下图曲线I所示。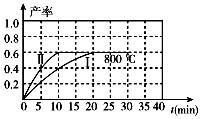
①反应Ⅱ相对于反应I而言,改变的条件可能是 。
②请在图中绘制出在其它条件与反应I相同时,反应在820℃时进行,NO的产率随时间的变化曲线。
③800℃时,若开始时向容器中同时加入1 mol/L NO、0.2 mol/L O2、0.5 mol/L NO2,则v(正) v(逆)。
(3)己知N2O4(g)  2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
2NO2(g) △H=+57.20kJ/mol,t时,将一定量的NO2、N2O4,充人一个容器为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:
①c( X)代表 (填化学式)的浓度,该反应的平衡常数K= 。
②前10 min内用NO2表示的反应速率为 ,20 min时改变的条件是 ;重新达到平衡时,NO2的百分含量 (填选项前字母)。
a.增大 b.减小 c.不变 d.无法判断
氧元素性质活泼,在众多的含氧化合物中氧元素显-2价,但也能形成一定数量的显正价的化合物。
(1)OF2是一种棕黄色有恶臭的气体,有极强的氧化性。
①OF2中氧元素的化合价为 。
②将Fz通入稀的NaOH溶液中可得到OF2、盐等物质,相应反应的化学方程式为________________。
(2)过氧化氢是一种绿色氧化剂、还原剂,工业上有多种方法制备H2O2。
①研究表明,H2O2相当于二元弱酸,则它的一级电离方程式为 ,已知常温下1L的H2O2相当于48.3 mol,其K1≈1.67×10 -12.则该温度下H2O2中c(H+)约为 ,写出它与足量Ba(OH)2反应的化学方程式为 。
②乙基蒽醌法是制备过氧化氢最常用的方法,其主要过程可以用右图表示,写出此过程的总反应方程式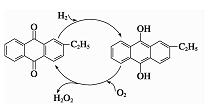
③空气阴极法制备H2O2是一种环境友好型、节能型制备方法,电解总方程式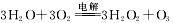 ,则阳极上电极反应式为 。
,则阳极上电极反应式为 。
(3)氧也能与钾元素形成K2O、K2O2、KO2、KO3等氧化物,其中KO2是一种比Na2O2效率高的供氧剂,写出它与CO2反应的化学方程式 。
(本小题满分15分)
参考下列图表和有关要求回答问题: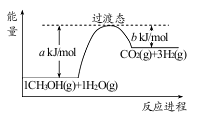
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2。右图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是_____________(填“增大”、“减小”、“不变”),反应热△H的变化是_____________(填“增大”、“减小”、“不变”)。请写反应进程出CH3OH(g)和H2O(g)反应的热化学方程式_____________。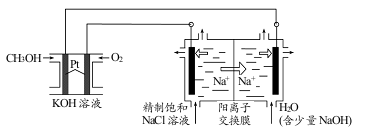
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:CH3OH(g)+1/2O2(g)  CO2(g)+2H2(g)△H="c" kJ/mol又知H2O(g)
CO2(g)+2H2(g)△H="c" kJ/mol又知H2O(g)  H2O(l)△H="d" kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
H2O(l)△H="d" kJ/mol。则甲醇燃烧生成液态水的热化学方程式为_____________。
(3)以CH3OH燃料电池为电源电解法制取ClO2。二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
①CH3OH燃料电池放电过程中,通入 O2的电极附近溶液的pH_____________,负极反应式为_____________。
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2。阳极产生 ClO2的反应式为_____________。
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为_____________mol。