A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化
合物的溶液中构成电池,则电池负极反应式为 。
研究证明,CO2可作为合成低碳烯烃的原料加以利用,目前利用CO2合成乙烯相关的热化学方程式如下: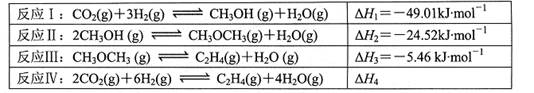
反应开始时在0.lMPa下,以n(H2):n(CO2)=3:1的投料比充入体积固定的密闭容器中,发生反应Ⅳ,不同温度下平衡时的四种气态物质的物质的量百分数如图1所示: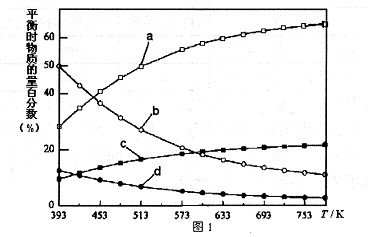
请回答下列问题:
(1)△H4=kJ-mol-1。
(2)可以判断该反应已经达到平衡的是。
A.v(CO2)="2" v (C2H4)
B.混合气体的密度不再改变
C.混合气体的压强不再改变
D.平衡常数K不再改变
E.C2H4的体积分数不变
(3)曲线a表示的物质为 (写化学式),判断依据是 。
(4)为提高CO2的平衡转化率,可以采取的措施是。
A.降低温度
B.分离出H2O
C.增加原催化剂的表面积
D.增大压强
E.投料比改为n(H2):n(CO2)=2:1
(5)在图2中,画出393K时体系中C2H4的体积分数随反应时间(从常温进料开始计时)的变化趋势曲线,并标明平衡时C2H4的体积分数数值。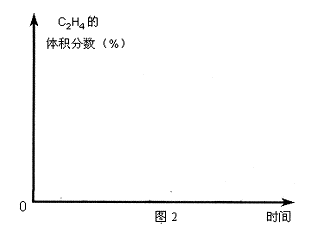
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A是原子半径最小的元素;B的基态原子中电子占有三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂。
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为______,E的基态原子的外围电子排布式为_______。
(2)A、B、C、D四种元素中电负性大小顺序的是__________________。
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程为_______________。
(4)下列叙述正确的是______(填序号)。
a.M是极性分子,N是非极性分子
b.M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示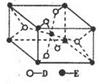
②已知:Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol;
2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECl4(l)和BD气体的热化学方程式:_________。
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)==2CA3(g)ΔH<0,其化学平衡常数K与温度t的关系如下表。请回答下列问题。
①试比较K1,K2的大小,K1________K2(填写“>”、“=”或“<”)。
②在40 0 0C时,当测得CA3 和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的v(C2)正____v(C2)逆(填写“>”、“= ”或“ < ”)。
选做【化学物质结构与性质】右图a~f分别表示由H、C、N、Na、Si、Cu元素组成的单质,其中c、d均为热和电的良导体。单质分别对应的熔点如图所示: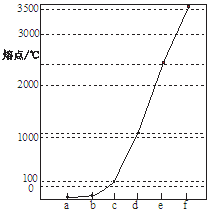
(1) 从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为;
从电负性角度分析,C、Si和N元素的非金属活泼性由强至弱的顺序为;
(2)图中d单质对应元素原子的电子排布式。用价层电子对互斥理论推断,单质a、b、f对应的元素以原子个数比1:1:1形成的分子中化学键的键角为。
(3)a与b的元素形成的10电子中性分子X,X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为。
(4)上述六种元素中的一种元素形成的含氧酸分子的结构模型(原子共平面)如图: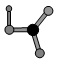
则可判断该元素原子(中心原子)的杂化方式是。氮化硅是一种高温陶瓷材料,硬度大、熔点高、化学性质稳定,其基本结构单元如图,则其化学式为_______。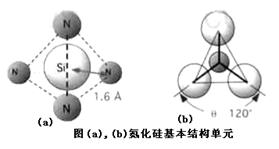
选做【化学—化学与技术】工业上一种制备氯化铁及高铁酸钾的工艺流程如下:
(1)吸收塔中的吸收剂X是;从副产物FeCl3溶液中获得FeCl3·6H2O的操作是、加热浓缩、再冷却结晶。
(2)用FeCl3溶液(副产物)腐蚀印刷线路板所得的废液中含FeCl3、FeCl2和CuCl2,用化学方法可以回收废液中铜;合并过滤后的剩余液体可以作为上述工艺流程中的吸收剂X。则在此过程中,先后加入的物质分别是。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析反应发生的原因:。K2FeO4在水溶液中易发生反应:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用(填序号)。
4Fe(OH)3+8OH-+3O2↑,在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用(填序号)。
a.H2O
b.稀KOH溶液、异丙醇
c.NH4Cl溶液、异丙醇
d.Fe(NO3)3溶液、异丙醇
运用化学反应原理分析解答以下问题。
(1)弱酸在水溶液中存在电离平衡,部分0.1 mol·L-1弱酸的电离平衡常数如下表:
| 弱酸 |
电离平衡常数(25℃) |
| HClO |
K=2.98×10-8 |
| H2CO3 |
K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 |
K1=1.54×10-2 K2=1.02×10-7 |
①当弱酸的浓度一定时,升高温度,K值______(填“变大”、“变小”或“不变”)。
②下列离子方程式和有关说法错误的是。
a.少量的CO2通入次氯酸钠溶液中:2ClO-+ H2O + CO2 =" 2HClO" + CO32-
b.少量的SO2通入碳酸钠溶液中:SO2+H2O+2CO32-= 2HCO3-+SO32-
c.相同温度时,等pH三种盐溶液的物质的量浓度关系:c(Na2CO3)< c(NaClO)< c(Na2SO3)
d.相同温度时,等物质的量浓度三种弱酸与足量NaOH溶液完全中和消耗NaOH的体积为:V(H2CO3) >V(H2SO3) >V(HClO)
③亚硒酸(H2SeO3)也是一种二元弱酸,有较强的氧化性。往亚硒酸溶液中不断通入SO2会产生红褐色单质,写出该反应的化学方程式:,该反应的氧化产物是。
(2)工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。
①在废水中存在平衡:2CrO42-(黄色)+2H+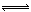 Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正反应方向移动,则下列说法正确的是。
a.平衡常数K值可以不改变
b.达到新平衡CrO42-的消耗速率等于Cr2O72-的消耗速率
c.再达平衡前正反应速率一定大于逆反应速率
d.平衡移动后达到新平衡溶液pH一定增大
②Cr2O72-和CrO42-最终生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)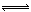 Cr3+(aq)+3OH‾(aq)
Cr3+(aq)+3OH‾(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,当c(Cr3+)降至10-3 mol·L-1,溶液的pH调至4时,________(填“有”或“没有”)沉淀产生。
(3)已知:①CO(g)+2H2(g)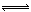 CH3OH(g)
CH3OH(g)
②2CH3OH(g)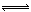 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
③CO(g)+H2O(g)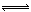 CO2(g)+H2(g)
CO2(g)+H2(g)
某温度下三个反应的平衡常数的值依次为a1、a2、a3,则该温度下反应3CO(g)+3H2(g)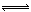 CH3OCH3(g)+CO2(g)的化学平衡常数K=L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。
CH3OCH3(g)+CO2(g)的化学平衡常数K=L4·mol-4(用含a1、a2、a3的代数式表示)。向某固定体积的密闭容器中加入3molCO和3molH2,充分反应后恢复至原来温度,测定容器的压强为反应前的2/3,则CO的转化率_________。