[物质结构与性质]元素周期表中第四周期的金属元素在生产和科研中有非常重要的使用价值。
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰。相关的反应如下:
4FeCl3+2NH2OH•HCl= 4FeCl2+N2O↑+6HCl+H2O
①Fe3+在基态时,核外电子排布式 ;
②羟胺中(NH2OH)采用sp3杂化的原子有 ,三种元素电负性由大到小的顺序为 ;
③Fe2+与邻啡罗啉(用A表示)形成的配合物[FeA3] 2+中,Fe2+的配位数为 ;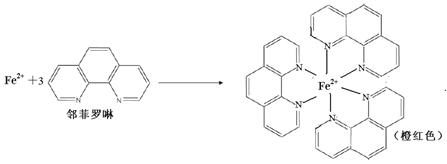
④N2O分子的空间构型为 (用文字描述)。
(2)氢的规模化制备是氢能应用的基础。在光化学电池中,以紫外线照钛酸锶电极时,可分解水制取H2同时获得O2。已知钛酸锶晶胞结构如图所示,则钛酸锶的化学式为 。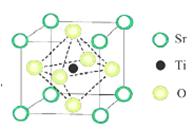
(1)相同物质的量的O2和O3的质量比________,分子个数比为________,所含氧原子的个数比为________。
(2)在200 mL 2 mol·L-1MgCl2溶液中,溶质的质量为______。此溶液中Mg2+的物质的量浓度为________,Cl-的物质的量浓度为___________________。
Ⅰ:如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:
2A(g)+B(g) 2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
2C(g); 反应达到平衡后,再恢复至原温度。回答下列问题:
(1)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是 。
(2)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,反应化学平衡常数为___________。
(3)若达到平衡时,隔板K最终停留在左侧刻度靠近0处, 则乙中可移动活塞F最终停留在右侧的刻度不大于 ;
Ⅱ:若一开始就将K、F固定,其它条件均不变,则达到平衡时:
(4)测得甲中A的转化率为b,则乙中C的转化率为 ;
(5)假设乙、甲两容器中的压强比用d表示,则d的取值范围是 。
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min |
n(CO)/mol |
n (H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.20 |
|
| t2 |
0.80 |
依据题意回答下列问题:
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。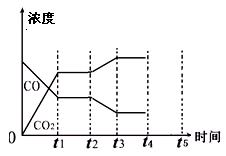
(3)温度升至800℃,上述反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
(4)700℃时,向容积为2L的密闭容器中充入CO(g)、H2O(g) 、CO2(g)、H2(g)的物质的量分别为1.20mol、2.00mol、1.20mol、1.20mol,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
(5)该反应在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
(6)若该容器绝热体积不变,不能判断反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
甲醇是一种可再生能源,在日常生活中有着广泛的应用.工业上用CO生产燃料甲醇,如:CO(g)+2H2(g)⇌CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
请回答下列问题:
(1)图1表示使用和未使用催化剂时反应过程和能量的对应关系.下列有关催化剂的说法不正确是
| A.降低分子的能量 | B.增加了活化分子数 |
| C.提高了活化分子百分数 | D.增加了单位体积内的活化分子数 |
(2)从反应开始到建立平衡,该过程中释放 kJ热量.
(3)在T2℃下,将2molCO和6molH2充入2L的密闭容器中,达到平衡状态时,测得c(CO)=0.2mol•L﹣1,则CO的转化率为 .
(4)如图3为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图如.电池总反应为2CH3OH+3O2⇌2CO2+4H2O.在电脑的使用过程中,电池的温度往往因为各种原因会升高.温度升高_____________(填:“有利于”或“不利于”)电池将化学能转化为电能.该装置中___________(填:“a”或“b”)为电池的负极,该电极反应式为 .
氯元素是生产生活中常见的非金属元素。
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式 ;不直接用Cl2作漂白剂的原因是 (写出两条)。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
①NaCl和Cl2中化学键的类型分别是 和 。
②燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl2 22.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③已知:2H2O2(l)=2H2O(l)+O2(g) ΔH1 = -196.46 kJ·mol-1
H2(g)+1/2O2(g)= H2O(l) ΔH2 = -285.84 kJ·mol-1
Cl2(g)+H2(g)=2HCl(g) ΔH3 = -184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。