(NH3经一系列反应可以得到HNO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是_____________________。
(2)II中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。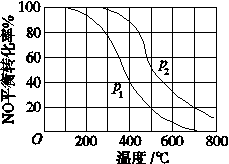
①比较P1、P2的大小关系:________________。
②随温度升高,该反应平衡常数变化的趋势是________________。
(3)III中,将NO2(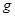 )转化为N2O4(
)转化为N2O4( ),再制备浓硝酸。
),再制备浓硝酸。
①已知:2NO2(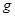 )
) N2O4(
N2O4(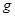 )△H1
)△H1
2NO2(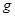 )
) N2O4(
N2O4( ) △H2
) △H2
下列能量变化示意图中,正确的是(选填字母)_______________。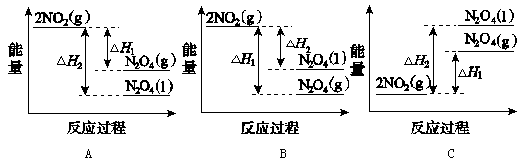
②N2O4与O2、H2O化合的化学方程式是_________________。
(4)IV中,电解NO制备NH4NO3,其工作原理如图所示,其阳极电极反应式为_____________,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____________,说明理由:________________。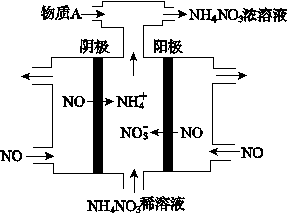
(1)明矾晶体可用来净水,它的化学式为。
(2)反应KClO3+6HCl=KCl+3Cl2↑+3H2O 中氧化剂是氧化剂和还原剂的物质的量之比:_______。
(3)加热10.0g碳酸钠和碳酸氢钠的混合物至质量不在变化,剩余固体的质量为8.45g,则混合物中碳酸钠的质量分数为。(填能或者不能)用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液。
A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是NO3-、SO42-、Cl-、CO32-中的某一种。根据你所学习的知识回答下列问题:①把四种盐分别溶于盛有蒸馏水的试管中,只有C盐的溶液呈蓝色。②向①的四支试管中分别加入盐酸,B盐有沉淀生成,D盐有无色无味气体溢出。
(1)四种盐的化学式分别为:A、_______;B、___________;C、__________;D、________。
(2)写出A与B、A与C反应的离子方程式:
A+B:;A+C:
( 3分)下列各组物质中都有一种在分类上与另外几种不同,试分析每组物质的特点,将不同于其他物质的那种找出来(把化学式填在横线上)。
(1)HCl、HNO3、H2SO4、HClO3:
(2)BaSO4、NaCl、CaCO3、AgCl:
(3)KCl、NaNO3、H2SO4、H2O:
现有以下物质:①NaCl 晶体②氨水③纯醋酸④ Fe⑤BaS04固体⑥蔗糖⑦盐酸⑧熔融的KN03⑨CO2请回答下列问题(用序号填空)
能导电的是_____ __属于电解质的是。
属于非电解质的是。
(2分)常温常压下CO与H2等体积混合总质量为15g,则混合气体中H2的质量是g。