(8分)孔雀石的主要成分为Cu2(OH)2CO3,还含少量铁的氧化物和硅的氧化物。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:
请回答下列问题:
(1)研磨孔雀石的目的是 。
(2)加入双氧水的目的是将溶液中的Fe2+转化为Fe3+,相应的离子方程式为 。
(3)固体c中主要成分的化学式为 。加入氧化铜的作用是 。
氯碱工业是高耗能产业,为了提高原料的利用率,将电解的Y气体作为燃料电池燃料,为电解池供电;X气体作为钛的冶炼原料,在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中氯碱工业装置中的电极未标出,所用的离子交换膜只允许阳离于通过。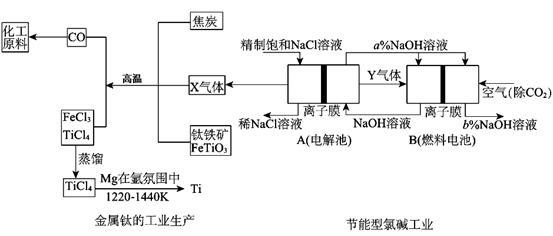
(1)①上图中的节能型氯碱工业部分,X、Y分别是、(填化学式),分析比较图示中NaOH质量分数a%与b%的大小;
②写出燃料电池B中正极上发生的电极反应:;
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式;
(3) TiCl4暴露在潮湿空气中冒白烟,白烟主要为白色的二氧化钛的水合物H2TiO3,写出该反应的化学方程式;
(4)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ·mol-1。
②1/2Ti(s)+ Cl2(g) =1/2TiCl4(1) △H=-385 kJ·mol-1。
则2Mg(s)+TiCl4(1)=2MgCl2(s)+Ti(s)的反应热为
(10分)A~G各物质间的关系如下图,其中B、D为气态单质。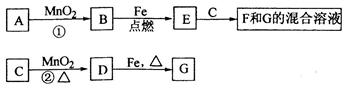
请回答下列问题:
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;
若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式为_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________, 实验现象为_____________________________________________。
实验现象为_____________________________________________。
(8分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8•nH2O)等化合物。
(1)三硅酸镁的氧化物形式为,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为。
(2)铝元素的原子核外共有种不同运动状态的电子、种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
(4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体 c.Al2O3、MgO和SiO2都是氧化物
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
.下图是周期表中短周期的一部分,A.B.C三种元素的原子核外电子数之和等于B的质子数的2倍。
1、(用元素符号表示)ABC
2、B的最高价氧化物的化学式,属于晶体。
3、C的气态氢化物的化学式,其中存在键。
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)在这些元素中,(用元素符号填写,下同)最活泼的金属元素是;最活泼的非金属元素是;最不活泼的元素是。
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的电子式是;能形成两性氢氧化物的元素是。
(3)②的氢化物分子式为,属于化合物(填“共价”或“离子”);
(4)⑥的元素符号为,原子结构示意图为
(5)①和⑦形成的化合物的电子式为。