用图示装置制备NO并验证其还原性。
(1)铜与稀硝酸反应的离子方程式是__________。
(2)滴入稀硝酸之前,应该关闭止水夹,点燃红磷并伸入瓶中,塞好胶塞。这样操作的目的是__________。
(3)滴入稀硝酸后,烧杯中的现象是__________。
(4)烧杯中的反应停止后,打开止水夹,通入__________可验证NO的还原性。
[2012·漳州质检]2012年1月,广西河池龙江河段检测出重金属镉离子(Cd2+)含量超标,当地政府积极展开治污工作。聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法。
已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al2O3、SiO2及铁的氧化物。
②聚合氯化铝([Al2(OH)nCl6-n]m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂。
以煤矸石为原料,采用铝盐水解絮凝剂,制得聚合氯化铝的工艺流程如下:
回答下列相关问题:
(1)向反应器中加入混合酸(20%的硫酸和盐酸)酸浸,其目的是。
(2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式。
(3)流程中残渣2的主要成分是,确认该成分中阳离子的方法是。
(4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的。
常温下以溶液pH为横坐标,Cd2+离子的除去率为纵坐标,实验结果如图所示,由图可知,Cd2+离子的除去率最高时,溶液的c(OH-)=。
[2012·北京朝阳一模]高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是________。
(2)步骤②反应的离子方程式是________。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为________。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。
(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_____
(答出两点即可)。
[2012·南通二调]碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的沉淀,该工艺中“搅拌”的作用是。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
[2012·北京石景山一模]我国制碱工业的先驱 侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。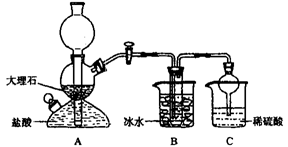
(1)A装置中所发生反应的离子方程式为。
C装置中稀硫酸的作用为。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)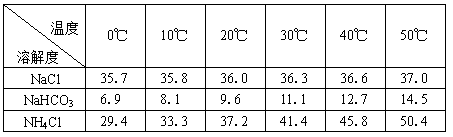
参照表中数据,请分析B装置中使用冰水的目的是。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在装置之间(填写字母)连接一个盛有的洗气装置,其作用是。
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为。
[2012·杭州一模]化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr溶液、KI(含淀粉) 溶液、NaOH(含酚酞)溶液、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(已知:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O)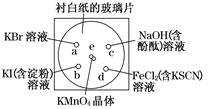
(1)e处反应的离子方程式为_____________________,该反应中发生反应的氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象为________________,d处的实验现象为___________________。
(3)c处反应的化学方程式为_____________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验能否比较Cl2、FeCl3、KMnO4三种物质氧化性的强弱? (填“能”或“不能”),若能,其氧化性由强到弱的顺序是 。