常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是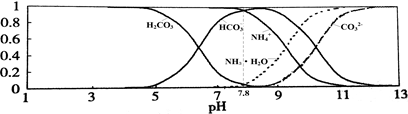
| A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
| D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-) |
常温下向20 mL 0.1mol/LCH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )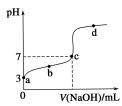
| A.a点表示的溶液中c(CH3COO-)略小于10-3 mol/L |
| B.b点表示的溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好完全中和 |
| D.滴定过程中溶液中的n (CH3COO-) +n(CH3COOH)的和不变 |
在恒温恒容密闭容器中,将CO和H2S混合并达到下列平衡:CO (g) +H2S (g)  COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是()
COS (g) +H2 (g),平衡常数K=1,反应前CO的物质的量为l0mol,平衡后CO物质的量为8mol。下列说法正确的是()
| A.若容器内压强不再变化,则说明该反应己达平衡 |
| B.反应前H2S物质的量为2.5mol |
| C.CO和H2S达平衡后的转化率相同 |
| D.若平衡后再加入CO,则正反应速率增大,逆反应速率减小 |
将1 mol SO2和1 mol O2通入恒温恒容密闭容器中,一定条件下达到平衡时SO3的物质的量为0.3 mol,此时若再加入1 mol SO2和1molO2,反应达到新的平衡时,SO3的物质的量是( )
| A.0.6 mol | B.小于0.6 mol |
| C.大于0.6 mol | D.大于0.3 mol,小于0.6 mol |
反应aA (g)+ bB (g)  cC(g)建立的平衡体系如图表示,则下列说法正确的是( )
cC(g)建立的平衡体系如图表示,则下列说法正确的是( )
| A.Tl>T2,△H<0 | B.Tl<T2,△H<0 | C.Pl>P2,a+b>c | D.Pl<P2, a+b>c |
在铜片上镀银时,下列叙述正确的是( )
| A.铜片接电源的正极 |
| B.铜片上发生的反应是:Ag++e-= Ag |
| C.银片上发生的反应是:4OH- - 4e-=O2↑+ 2H2O |
| D.需用硫酸铜溶液为电镀液 |