已知:CH4(g)+2O2(g)→CO2(g)+2H2O(l)+Q1;2H2+O2(g)→2H2O(g)+Q2;2H2+O2(g)→2H2O(l)+Q3;
若体积比为4:1的甲烷与氢气的混合气体11.2L(S.T.P)在氧气中完全燃烧,恢复至室温,放出的热量为_________________(表达式)。
现有饱和一元醇的混合物和饱和一元羧酸的混合物在一定条件下反应生成多种酯的混合物,酯的相对分子质量分别为M1、M2、M3,并依次增加14。经分析,相对分子质量为M2的酯,其中氧元素所占的质量分数为31.4%,并有三种酯的同分异构体。
请完成下列问题:
(1)相对分子质量为M2的酯的分子式为______________________________。
(2)饱和一元羧酸的分子式分别为______________________,______________________。
(3)参加反应的醇的结构简式为_______________、_______________、_______________、_______________(不必填满)。
(4)与相对分子质量为M1的酯互为同分异构体,能发生银镜反应,能与金属钠反应产生氢气的有机物的同分异构体有_______________种。
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为: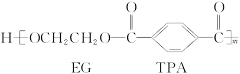
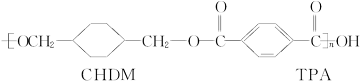
已知:
②RCOOR1+R2OH RCOOR2+R1OH(R、R1、R2表示烃基)
RCOOR2+R1OH(R、R1、R2表示烃基)
这种材料可采用下列合成路线: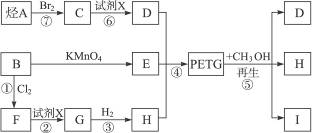
试完成下列问题:
(1)反应②⑥加入的试剂X是___________。
(2)⑤的反应类型是___________。
(3)写出结构简式:B___________,I___________。
(4)合成时应控制的单体的物质的量
n(D)∶n(E)∶n(H)= ___________∶___________∶___________。(用m、n表示)
(5)写出化学反应方程式:
反应③:_______________________________________________________;
反应⑥:_______________________________________________________。
乙二酸和乙二醇在不同条件下反应,会生成三种不同的酯,其中普通酯是一个乙二醇分子跟一个乙二酸分子反应生成的分子式为C4H6O5的酯,另一种是分子式为C4H4O4的环状酯,还有一种高分子酯,试写出它们的结构简式:
(1)普通酯_________________________________________________。
(2)环状酯__________________________________________________。
(3)高分子酯________________________________________________。
醛可以跟亚硫酸氢钠饱和溶液发生加成反应,生成物是水溶性的α羟基磺酸钠:
R—CHO+NaHSO3 RCH(OH)—SO3Na
RCH(OH)—SO3Na
反应是可逆的,在通常条件下有70%—90%向正方向转化。
(1)若氯苯中混有杂质苯甲醛,欲将此杂质全部除去,可采用试剂是_______________,其分离方法_____________________________________________________________________。
(2)若使CH3CH(OH)—SO3Na全部生成乙醛,可采用试剂是___________或____________,其分离方法是__________________________________________________________________。
有四种无色液体:60%的酒精、福尔马林、甲酸和醋酸。只使用一种试剂M鉴别它们,其鉴别过程如下: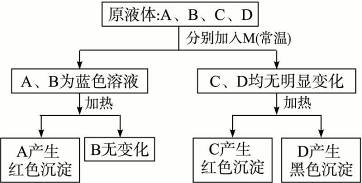
(1)试填写A—D所含有机物的结构简式。
A:______________,B:_______________,C:_______________,D:______________。
(2)试剂M的化学式:______________________________。