【原创】在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,C的氧化物是导致光化学烟雾的主要原因,D原子核外电子有8种不同的运动状态, E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)写出基态E原子的价电子排布式 。
(2)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;
(3)根据等电子体原理,写出BD化合物的电子式 ;
(4)A2D由液态形成晶体时密度减小,主要原因是 (用文字叙述)。
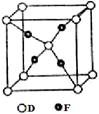
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为
(用元素符号表示);该化合物在稀硫酸中发生歧化反应,写出该化学反应方程式 。

某工厂的工业废水中含有大量的FeSO4,较多的Cu2+和少量Na+。该工厂计划从废水中回收FeSO4和金属铜。根据下列流程图,回答问题。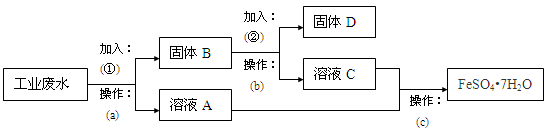
(1)a操作需要用到的玻璃仪器有。
(2)加入的试剂①为,要判断所加试剂①是否过量,其操作方法是。
(3)加入试剂②发生反应的离子方程式是。
(4)c操作为、冷却结晶、、洗涤、干燥。
粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是, 滴加Na2CO3溶液时发生反应的化学方程式为。
(3)用提纯后的NaCl固体配制100mL 1.0 mol/L NaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要 (填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏________(填“高”或“低”,下同);定容时仰视刻度线会造成所配溶液浓度偏________。
北京市规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
Ⅰ.用天平准确称取5.0 g食盐样品,加适量蒸馏水使其完全溶解。
Ⅱ.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
Ⅲ.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液3.0 mL,恰好反应完全。
(1)步骤Ⅱ中反应后碘元素以形式(填物质的化学式)存在。
(2)已知步骤Ⅲ中S2O32-反应后转化为S4O62-,写出步骤Ⅲ的离子方程式。
(3)上述实验样品中碘含量是mg/kg。
现有含NaCl、Na2SO4、Na2CO3和NaHCO3的固体混合物。某同学为测定其中各组分的含量,取部分样品溶于水,并设计了如下实验流程(所加试剂均为过量,反应①~③均为复分解反应)。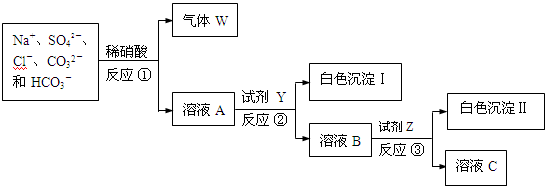
请回答: (1)气体W的化学式是。
(1)气体W的化学式是。
(2) 溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
溶液A中主要存在的微粒除了Na+、SO42-、Cl-之外还有。
(3)反应②和③之后均需进行的操作的名称是。
(4)试剂Y是(填化学式)。
(5)测定各组分的含量,需要测的数据有:混合物总质量、白色沉淀Ⅰ和Ⅱ分别的质量和 。
有以下物质:①Mg②Al③C④稀硫酸⑤浓硫酸⑥NaOH溶液
(1)写出①与④反应的离子方程式。
(2)既能跟④又能跟⑥反应的是(填序号),写出它与⑥反应的化学方程式。
(3)写出写出③与⑤反应的化学方程式,下列关于该反应中⑤体现的性质说法正确的是。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性