800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随时间的变化如表:
2NO2(g)体系中, n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
计算并回答下列问题:
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
(3)反应达到平衡状态时NO的转化率= 。(提示: )
)
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 5.00%的
5.00%的 溶液、足量的
溶液、足量的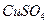 溶液和l00
溶液和l00 10.00%的
10.00%的 溶液.电极均为石墨电极。
溶液.电极均为石墨电极。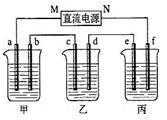
(1)接通电源,经过一段时间后,测得丙中 浓度为10.47%,乙中c电极质量增加。据此回答问题:
浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______________极;
②电极b上发生的电极反应为______________________________;
③列式计算电极b上生成的气体在标准状况下的体积:_______________;
④电极c的质量变化是_______________ ;
;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液____________________________________________________________;
乙溶液____________________________________________________________;
丙溶液____________________________________________________________;
(2)如果电解过程中铜全部析出.此时电解能否继续进行,为什么?
____________________________________________________________。
从H+、Cu2+、Na+、SO42-、Cl-五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极进行电解,使电解质质量减少,水质量不变,可采用的电解质有__________
(2)以石墨为电极进行电解,使电解质质量不变,水质量减少,可采用的电解质有_________(3)以石墨为电极进行电解,使电解质和水的质量都减少,可采用的电解质有_______________
(5分) (1)常温下,pH=11的NaOH溶液稀释1000倍后溶液的pH为_______________,稀释105倍后溶液的pH为_______________
(2)在pH为11的Ba(OH)2溶液中,溶质的物质的量浓度为_______________mol/L,水电离出的C(OH-)为_______________mol/L
(3)25℃时,将pH=10和pH=12的NaOH溶液等体积混合,混合后溶液的pH=_______________。
(1)写出下列物质的电离方程式:
①H2S:______________________________
②NaHCO3溶于水:______________________________
③NaHSO4溶于水:______________________________
(2)下出下列盐的水解方程式(离子方程式):
①NH4Cl: ______________________________
②明矾净水原理(只写相应离子的水解方程式):______________________________
③泡沫灭火器(硫酸铝和碳酸氢钠)的灭火原理:______________________________
(3)写出难溶电解质的溶度积表达式。Mg(OH)2:______________________________
(4)下出下列反应方程式:
①钢铁发生吸氧腐蚀的正极反应式:______________________________
②氢氧燃料电池,H2SO4做电解质溶液,正极反应式:______________________________
③电解饱和食盐水的总反应方程式:______________________________
下图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质。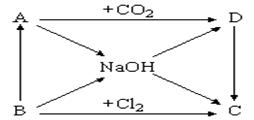
(1)写出C的化学式:________________ 。
(2)写出实现下列变化的化学方程式:
① B → NaOH:________________________________________,
② A → D:________________________________________ ,
(3)浓NaOH溶液能跟地壳中含量最多的金属元素的单质反应,写出该反应的离子方程式:____________________ 。