(14分)铜、铬都是用途广泛的金属。工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收金属铜和铬的流程如下图:
已知:部分物质沉淀的pH如下表: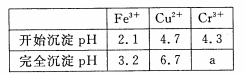
CaSO4的溶解度曲线如图: 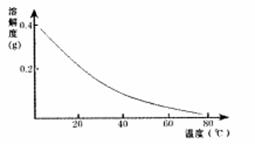
请回答下列问题:
(1)滤液I中所含溶质主要有 (填化学式)。
(2)第②步操作中,先加人Ca(OH)2调节溶液的pH,调节范围为____,然后将浊液加热至80 ℃ 趁热过滤,所得滤渣Ⅱ的成分为 。
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体。写出该步骤中发生反应的离子方程式
(4)当离子浓度≤1× 10-5mol· L-1 l时,可以认为离子沉淀完全。第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为 。(已知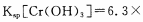
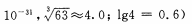
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬。写出铝热法炼铬的化学方程式
某研究小组探究:
I .铜片和浓硫酸的反应(夹持装置和A中加热装置已略,气密性已检验)
II. SO2和 Fe( NO3)3溶液的反应[1.0 mol/L的 Fe(NO3)3溶液的 pH=1]请回答下列有关问题:
探究I
(l)某学进行了下列实验:取12.8g铜片和20 mL 18 mol•L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。
①装置A中反应的化学方程式是_______
②该同学设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
| A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称貴 |
| B.将产生的气体缓缓通入酸性髙锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定其产生气体的体积(折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况) |
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______。
(3)裝置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1:SO2与Fe3+反应;猜想2 :在酸性条件下SO2与NO3-反应;猜想3:____________;
①按猜想1,装置B中反应的离子方程式是______,证明该猜想应进一步确认生成的新物质,其实验操作及现象是____________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
a.0.1 mol/L 稀硝酸 b. 1.5 mol/L Fe(NO3)2溶液
c. 6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
某化学兴趣小组拟采用下图所示装置电解饱和氯化钠溶液制备H2,通过H2还原氧化铜测定Cu的相对原子质量Ar(Cu),同时检验Cl2的氧化性(图中夹持和加热仪器已略去)。
(1)直流电源中的X极为极(填“正”、“负”、“阴”或“阳”);写出甲装置U形管中反应的离子方程式:;实验开始后,用铁棒作电极的一侧的实验现象是。
(2)为完成上述实验,正确的链接顺序为:a连,b连(填写连接的字母)。
(3)装置乙中的G瓶内溶液可能为(填字母)。
| A.淀粉KI溶液 | B.NaOH溶液 | C.Na2S溶液 | D.Na2SO3溶液 |
H瓶内的反应的离子方程式为:。
(4)在对硬质玻璃试管里的氧化铜粉末加热前需要进行的操作为:。
(5)装置丙中N瓶内盛放的试剂为,作用是。
(6)为了测定Cu的相对原子质量,某同学通过实验测得如一下数据:
I.氧化铜样品质量为m1g
Ⅱ.反应后硬质玻璃管中剩余固体质量为m2g
Ⅲ.反应前后U形管及其固体质量差为m3g
Ⅳ.反应前后瓶及其液体质量差为m4g
①请选择理论上误差最小的一组数据计算Ar(Cu),Ar(Cu)=。
②如果选用其它数据进行计算,会导致Ar(Cu)(填“偏大”、“偏小”或“无影响”),理由是。
A装置中装有淡黄色的固体,分液漏斗中装有浓盐酸,B中盛浓硫酸,C中放有催化剂,D中盛淀粉碘化钾溶液,E中盛足量的NaOH溶液,F中盛FeSO4和H2SO4混合溶液。
先打开止水夹,通入N2,待装置中空气被赶尽后关诩止水夹,点燃酒精灯:从分液漏斗放入浓盐酸,D中溶液迅速变蓝,F中溶液由浅绿色变为棕黄色(整个装置乖O3)。
(1)淡黄色固体所含化学键的名称为:________;装有遮黄色的固体仪器的名称_______。
(2)如何检查装置的气密性___________________________________________________。
(3)C中反应的化学方程式___________________________________________________。
(4)E装置中反应的离子方程式_______________________________________________。
(5)如F中仍有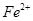 ,如何检验含有Fe2+____________________________________。
,如何检验含有Fe2+____________________________________。
工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理
①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式。
(2)实验装置(如图所示)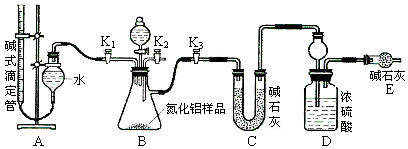
(3)实验过程
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL。
②称取xg AlN样品置于锥形瓶中;塞好胶塞,关闭活塞,打开活塞,通过分液漏斗加入稀硫酸,与烧瓶内物质充分反应。
③待反应进行完全后,关闭活塞,打开活塞,通过分液漏斗加入过量(填化学式),与烧瓶内物质充分反应。
④(填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析
①AlN的质量分数为。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积(填“偏大”、“偏小”或“无影响”)。
③Al4C3的质量分数为。(该实验条件下的气体摩尔体积为Vm)。
过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1)根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):。
①②③④⑤
(2)装置④的作用是。
(3)如果实验时,称取w g样品和过量盐酸反应后,测得氧气的体积(标准状况)为V mL,则此样品的纯度为。