某研究小组为了探究Fe3+与I-的反应是否为可逆反应,设计了如下实验:

(1)取少量溶液1于试管中,加入少量淀粉溶液,震荡,溶液变蓝,说明Fe3+与I-的反应有_______生成(填化学式)。
(2)上述操作1的名称:________,所用的主要仪器是________,上层溶液的颜色___________。
(3)该小组对下层溶液滴加KSCN溶液未见红色的原因,提出了下列两种猜想:
猜想一:___________________________;
猜想二:残留的Fe3+与SCN-结合生成的Fe(SCN)3浓度极小,其溶液颜色肉眼无法观察。
为了验证猜想,在查阅资料后,获得下列信息:
Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
(4)若猜想1成立,请写出该反应的离子方程式:______________。
(5)若猜想2成立,请自行设计实验验证。
| 实验步骤 |
预期现象与结论 |
| |
|
实验室配制500ml0.2mol/L的Na2SO4溶液,实验操作有以下步骤:
a.在托盘天平上称量出14g Na2SO4放于烧杯中加适量蒸馏水溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续用烧杯向容量瓶中加水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液都小心注入容量瓶中,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀;
f.将所得溶液倒入指定试剂瓶中,贴好标签封存备用。
填写下列空白:
(1)操作步骤的正确顺序是 (填序号)。
(2)本实验用到的基本仪器已有托盘天平(带砝码)、镊子,还缺少的仪器有 。
(3)上述步骤中有明显错误的是 (填序号)。
(4)下列情况会使所配制溶液浓度偏高的是 (填序号):
①定容时俯视;
②定容时仰视;
③没有进行上述操作步骤d;
④加水时不慎超过了刻度线,发现后用胶头滴管吸出;
⑤称量时用的砝码上沾有杂质;
⑥容量瓶使用前没有干燥内壁附有水珠。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,右图为两套实验装置。

(1)写出下列仪器的名称:
①____________;②____________;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 ;图I实验过程中使用冷凝管时应从 处进水(均填序号)。
(3)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器有 ;将仪器补充完整后进行的实验操作的名称为: 。现需配制500 ml 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是 。
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④
⑤转移、洗涤 ⑥定容、摇匀 ⑦装瓶贴标签
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中_______________;
B.容量瓶用蒸馏水洗涤后残留有少量的水______________;
C.所用过的烧杯、玻璃棒未洗涤________________;
D.定容时俯视刻度线________________。
(每空2分,共16分)下图为实验室制取蒸馏水的实验装置图:
请根据图示回答下列问题:
(1)指出图中两处明显的错误:①___ __,②_______ _。
(2)仪器A、B、C、D的名称分别是________、________、________、________。
(3)实验时,A中除加入少量自来水外还需要加入少量__________,其作用是__________。
(7分)海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI===2KCl+I2。请回答下列问题:
(1)指出提取碘的过程中有关实验操作①、③的名称:________;________。
(2)在3 mL碘水中,加入1 mL四氯化碳,振荡、静置后,观察到试管里的分层现象是________。(注:如图试管中深色区为紫红色溶液)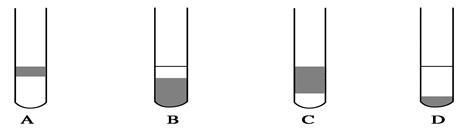
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图实验装置中的错误之处。(加热装置烧杯下已垫石棉网)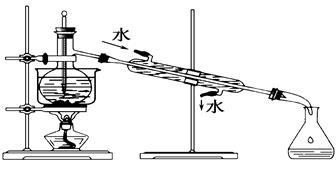
①____________________________;
②_____________________________。