(10分)现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4 g C与足量热水反应时,在标准状况下放出气体2.24 L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B________,C________,指出D在周期表中的位置_____________。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为______________(用化学式表示)。
(3)写出淡黄色固体E的电子式________,其中含有的化学键为____________。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式__________________。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为________。
(12分) 碳及其化合物与人类关系密切
(1)碳原子的价层电子排布图为,C、N、O三元素的第一电离能由大到小的顺序为,在丙烯分子中碳原子的杂化方式为。
(2)固体CO2俗称干冰,干冰可用于人工降雨的原因是,干冰晶体内存在的粒子间作用力有,其中一个分子周围紧邻的分子有个。干冰为面心立方晶体,若其晶胞边长为apm, 列式表示该晶体的密度g·cm-3 (只列出表达式,不必化简)。
(3)金刚石的晶胞如下图(均为同种原子),碳原子的配位数是,碳原子与碳碳键个数比为,碳原子空间利用率为 (计算结果保留两位有效数字。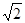 =1.41
=1.41 =1.73)。
=1.73)。
现有下列几种物质:
①CaS ②Ar ③CaO2 ④金刚石 ⑤SiC ⑥H2O2 ⑦(NH4)2SO4⑧MgCl2 ⑨CH3COONa ⑩[Cu(NH3)4]SO4(以下空格均填写序号)
(1)不含极性键的分子晶体是;(2)含有极性键的分子晶体是;
(3)只含离子键的离子晶体是;(4)含有极性键的原子晶体是;
(5)含有非极性键的离子晶体是;(6)含有配位键的离子晶体是 。
(1)Cu2+能与NH3、Cl-等形成配位数为4的配合物,已知[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为。
(2)下图是铜的某种氧化物的晶胞结构示意图,该晶体的密度为a g/cm3,设阿伏伽德罗常数的值为NA,则该晶胞的体积为cm3
(3)0.01mol氯化铬晶体(CrCl3·6H2O)在水溶液中用过量的AgNO3溶液处理,产生0.02molAgCl沉淀,此氯化铬晶体最可能为
a.[Cr(H2O)6] Cl3 b.[Cr(H2O)5 Cl] Cl2·H2O
c.[Cr(H2O)4Cl2] Cl·2H2O d.[Cr(H2O)3Cl3]·3H2O
(4)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。其中Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
(填晶体类型)。CO与N2 互为等电子体,与CO互为等电子体的离子为(任写一种);
(5)已知含氧酸可用通式XOm(OH)n来表示,如X是S,当m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m值大的酸性强,m值小的酸性弱。下列各含氧酸中酸性最强的是
a.HClO2b.H2SeO3 c.H3BO3d.HMnO4
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大。A与其他4种元素既不在同一周期又不在同一族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第8列元素。D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图。请回答:
(1)基态E3+离子核外有种运动状态不同的电子。
(2)写出B的单质与水反应的离子方程式;
(3)如图所示,D跟B形成的离子化合物的化学式为;鉴别该离子化合物是否为晶体,最可靠的科学方法是。
(4)A与B形成的化合物在气态时存在(AB)2二聚分子,原因是;A与B形成的化合物比A与C形成的化合物熔点要____(填高或低)
该题分I、II两小题。
I.金刚石和石墨是碳元素的两种常见单质,下列叙述中正确的有
a.金刚石中碳原子的杂化类型为sp3杂化,石墨中碳原子的杂化类型为sp2杂化
b.晶体中共价键的键长:金刚石中C—C<石墨中C—C
c.晶体的熔点:金刚石<石墨
d.晶体中共价键的键角:金刚石>石墨
II.高温超导材料富勒烯化合物是当前研究的热点物质。
(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如下图所示。该富勒烯化合物中的化学式为。
(2)金属钾采用的是下列(填字母代号)堆积方式,每个钾原子的配位数是。
(3)金刚石中的C-C的键长为154 pm,C60中C-C键长为140~145 pm。有同学据此推断C60的熔点高于金刚石,你认为(填“是”或“否”)正确,并阐述理由:。