(12分)【物质结构与性质】A、B、C、D、E、F都是元素周期表中前20号元素,其原子序数依次增大。B、C、D、E同周期,A、E同主族,F和其它元素既不在同周期也不在同主族。B、D、E的最高价氧化物的水化物均能互相反应生成盐和水,E的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述B、C、D、E四种元素中第一电离能由小到大的顺序是 ,电负性由大到小的顺序是 ,A、B、D、E离子半径由小到大的顺序为 (填相关元素或离子的符号)。
(2)A和E的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
(3)A和F可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为 ,含阴离子的数目为 ,该离子化合物的化学式为 。

有机物A是一种重要化工生产的中间体,已知结构简式为 :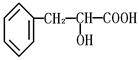
(1)A中含的官能团有:
(2)A可能具有的化学性质有:(填写序号)
① 能与H2发生加成反应 ②能与甲醇发生酯化反应 ③能与甲酸发生酯化反应
④ 在浓硫酸和加热的条件下发生消去反应 ⑤能与A g(NH3)2OH溶液发生氧化反应
(3)在一定条件下,用有机物A可以合成高分子化合物C [(C9H8O2)n ]。请写出反应的化学方程式(要求有机物写结构简式):
。
现有XYZ三种元素。
(1)X的单质可以在Z的单质中燃烧生成XZ,火焰为苍白色。
(2)XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红。
(3)X、Y、Z的单质在常温下为气体。
(4)两分子X的单质可以和Y单质化合生成两分子X2Y(常温下为液体)。
(5)Z的单质溶于X2Y中得到溶液具有漂白性,推断
①XYZ各为何元素(写元素符号)?X__________ Y__________ Z__________
②XZ和X2Y各是什么物质(写化学式)? XZ__________ X2Y__________
据报道,苏州一女士骑自行车随助力车行走,因大雾堵车在许多助力车排放的尾气中呆久后突然晕倒,路人急将其送往医院抢救。化学兴趣小组同学看报后组织讨论以下两个问题,请你参考:
(1)该女士昏倒的原因: 。
(2)讨论中某同学为解决助力车污染空气的问题,提出以下几点建议:①用浓氢氧化钠溶液吸收尾气中有毒成分;②用灼热的氧化铜把尾气中有毒成分反应出去;③控制行驶的助力车的数量;④改进助力车发动机的结构,提高汽油燃烧效率。你认为切实可行的是 ,试分析不行的原因 。
(1)近年来,化合物的种类增长得很快,其总数已经超过了_____万种;其中大多数是_____(选填:①地球上原来就有的 ②科学家人工合成的);形成这些化合物的元素仅有_____多种。
(2)人类对化学的研究经历了古代化学、、三个阶段。在微观层面上操纵分子和原子是才能研究的内容。
面粉加工厂的车间里若悬浮着较多的面粉粉尘,遇明火就有发生爆炸的危险。下面是模拟粉尘爆炸的一个实验。如下图,在小塑料筒里放入干燥面粉,点燃蜡烛,用塑料盖盖住金属筒,迅速鼓入大量空气,不久,便会听到“砰”的一声,爆炸的气浪将金属筒上的塑料盖掀起。试问: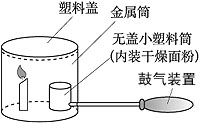
(1)在上述实验中,鼓入空气的作用是______________。
(2)下列情况下,不会发生爆炸的是_______________(填序号)。
①金属筒不加盖时;②蜡烛没有点燃时;③塑料筒中装的是煤粉时。
(3)面粉厂为了避免爆炸事故发生,应采取的安全措施有____________(写出一种即可)。