[化学——选修3:物质结构与性质]已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有____(填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
如图为电解装置,X、Y为电极材料,a为电解质溶液。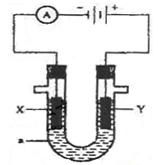
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是;
写出Y电极的电极反应式。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是;
写出X电极的电极反应式。
(3)若要利用该装置在铁制品表面镀上一层银,则a为 ,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH (填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入 。
请按要求填空:
I.现有:①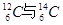 、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( )
、② O2与O3、③ 正丁烷与异丁烷、④ 金刚石与石墨、⑤ 冰与水、⑥ 乙醇与二甲醚。请用序号填写对应的分类:(1)互为同位素的是( );(2)互为同素异形体的是 ( );(3)互为同分异构体的是( );(4)属于同一化合物的是 ( )
II.现有以下物质:①NaCl晶体②液态(纯)H2SO4③液态的(纯)醋酸④汞(金属)⑤纯蔗糖(C12H22O11)⑥酒精(C2H5OH)⑦熔化的KNO3,请回答下列问题(用序号):
(1)以上物质中能导电的是( ),
(2)以上物质中属于电解质的是( ),
(3)以上物质中属于非电解质的是( ),
(4)以上物质中溶于水后形成的水溶液能导电的是( )。
(8分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是_____________________________。
(2) 化合物Y2X2的电子式为________;它含有的化学键类型有_________(填序号)。
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_______________。
(4)化合物A2X和A2S中,沸点较高的是 (填化学式)
(5)常温常压下,由A,B,X三种元素组成一种常见的液态燃料甲.现有2.3克甲与4.8克的X单质恰好完全反应,生成标准状况下2.24L的BX2气体和2.7克的A2X液体,同时放出68.35KJ的热量,该反应的热化学方程式为
(4分)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol①
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-543 kJ/mol②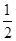 H2(g)+
H2(g)+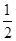 F2(g)===HF(g) ΔH3=-269 kJ/mol③
F2(g)===HF(g) ΔH3=-269 kJ/mol③
H2(g)+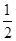 O2(g)===H2O(g) ΔH4=-242 kJ/mol④
O2(g)===H2O(g) ΔH4=-242 kJ/mol④
(1)肼和二氧化氮反应的热化学方程式为____________________________
(2)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:__________
(9分)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸.当X无论是强酸还是强碱时,都有如下转化关系:当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素.回答下列问题: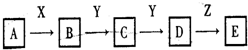
(1)A是______,Y是______,Z是______.
(2)当X是强碱时,E是______,当X是强酸,E是______.
(3)写出A与X反应的离子方程式:①___ ___;②____ __