硼及其化合物在耐髙温合金工业、催化剂制造、髙能燃料等方面应用广泛。
(1)氮化硼是一种耐高温材料,巳知相关反应的热化学方程式如下:
2B(s)+N2(g)=" 2BN(s)" ΔH="a" kJ • mol-1
B2H6 (g)="2B(s)" + 3H2 (g) ΔH ="b" kJ • mol-1
N2 (g) + 3H2 (g)  2NH3 (g) ΔH ="c" kJ• mol-1
2NH3 (g) ΔH ="c" kJ• mol-1
①反应B2H6(g)+2NH3(g)="2BN(s)" +6H2(g) ΔH = (用含a、b、c 的代数式表示)kJ ·mol-1。
②B2H6是一种髙能燃料,写出其与Cl2反应生成两种氯化物的化学方程式: 。
(2)硼的一些化合物的独特性质日益受到人们的关注。
①最近美国化学家杰西·萨巴蒂尼发现由碳化硼制作的绿色焰火比传统焰火(硝酸钡)更安全,碳化硼中硼的质量分数为78. 6%,则碳化硼的化学式为 。
②近年来人们将LiBH4和LiNH2球磨化合可形成新的化合物 Li3BN2H8和Li4BN3 H10,Li3BN2H8球磨是按物质的量之比n(LiNH2) : n(LiBH4) =" 2" : 1加热球磨形成的,反应过程中的X衍射图谱如图所示。

Li3BN2H8在大于250℃时分解的化学方程式为 ,Li3BN2H8与Li4BN3H10的物质的量相同时,充分分解,放出等量的H2,Li4BN3 H10分解时还会产生固体Li2NH和另一种气体,该气体是 。
(3)直接硼氢化物燃料电池的原理如图,负极的电极反应式为 。电池总反应的离子方程式为 。

(6分)A、B、C、D四种短周期元素,原子序数D>C>B>A,且B、C、D同周期,A、D同主族,B 原子的最外层只有一个电子,C的原子结构示意图
为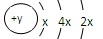 ,D在同周期元素中原子半径最小,据此填空:
,D在同周期元素中原子半径最小,据此填空:
(1)C元素的名称为,其气态氢化物的化学式为
(2)D在周期表的周期,族。
(3)A、B、C、D四种元素的原子半径由大到小的顺序为(用元素符号填写)
(4)B的最高价氧化物的水化物的化学式为
(每空2分共10分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。若把体系温度降至800℃求得平衡常数K1=0.81,可以推知该反应的正反应为__________反应(填“吸热”、“放热”)。
(2)800℃时,某时刻测得体系中各物质的量如下:n(CO2)=1.2mol,n(H2)=1.5mol,n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应进行.(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
(1)0~10min 容器内气体的压强逐渐 ___________。(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___第13min时曲线变化的原因可能是 __(填序号)
①增加Z的量 ②增加X的量 ③升温 ④降温 ⑤使用催化剂
、煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。 已知:CO(g)+H2O(g)
已知:CO(g)+H2O(g) 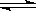 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
1000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
试回答下列问题
(1)该反应的化学平衡常数表达式为K=。
(2)上述正向反应是:反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向
反应方向移动(填“正”或“逆”),
正反应速率(填“增大”、“减小”或“不变”),
容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(4)在830℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有(选填A、B、C、D)。
| A |
B |
C |
D |
|
| n(CO2) |
3 |
1 |
0 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
| n(CO) |
1 |
2 |
3 |
0.5 |
| n(H2O) |
5 |
2 |
3 |
2 |
已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空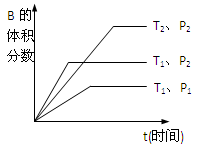
①化学计量数的关系:m+n______q;(填“>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)
某温度下,在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如下图。反应在t1min时到达平衡,依图所示:
⑴该反应的化学方程式是__________________________。
⑵反应起始至t1min,Y的平均反应速率是___________。
⑶ X的物质的转化率是________。