能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)250℃时,以镍合金为催化剂,向4L容器中通入6molCO2、6 molCH4,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=___________。
②若再向容器中同时充入2.0molCO2、6.0 molCH4、4.0 molCO和8.0molH2,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH=—41.8KJ·mol-1
SO3(g)+NO(g) ΔH=—41.8KJ·mol-1
2SO2(g)+O2(g) 2SO3(g) ΔH=—196.6KJ·mol-1
2SO3(g) ΔH=—196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
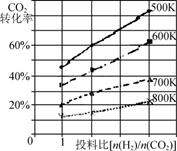
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(CO2)(正)=3v(H2O)(逆)
B.混合气体中氢气的质量不变
C.容器内压强保持不变
D.混合气体的密度保持不变
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(4)通过NOx传感器可监测大气中NOx的含量,其工作原理如图所示,甲、乙两电极均为Pt电极,电解质为熔融氧化物。

①乙电极上发生的是_________反应(填“氧化”或“还原”);
②甲电极上的电极反应式为___________________。
回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
(1)除去SiO2固体中混有的Al2O3,方法是:;
其离子方程式为:。
(2)除去FeCl2溶液中的少量FeCl3,方法是;其离子方程式为:。
(3)除去Na2CO3固体中的少量NaHCO3,方法是:;其化学方程式为:;
金属的性质与其结构有密切的关系,金属晶体由于某些结构上的相似点导致了金属具有一些共同的性质;同样由于结构上的不同点,导致了每种金属都具有各自的特性。
(1)请指出金属具有延展性的原理是
(2)金属的紧密堆积有不同的形式,请画出金属钠的晶胞,并指出一个晶胞含有几个钠原子?
(3)计算该晶胞的空间利用率?
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+S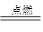 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上述元素的电负性从大到小依次为;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为_______, A的晶体类型为____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为__________,Q2+的未成对电子数是____________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为。
一种离子晶体的晶胞如右图其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
(1)每个晶胞中含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子周围距离最近的阴离子数为_____,阴离子周围距离最近的阳离子数_____。
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。