某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学上常用作还原剂。为确定其组成,某小组同学进行如下实验。
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示,实验步骤如下:
①准确称取19.60 g晶体X,加水溶解,注入圆底烧瓶中;
②准确量取50.00 mL l.0100 mol H2SO4溶液于锥形瓶中;
H2SO4溶液于锥形瓶中;
③向圆底烧瓶中加入足量NaOH溶液,加热蒸馏;
④用0.0400 mol NaOH标准溶液滴定锥形瓶中过剩的酸,到终点时消耗NaOH标准溶液25.00 mL。
NaOH标准溶液滴定锥形瓶中过剩的酸,到终点时消耗NaOH标准溶液25.00 mL。
(1)步骤②中,准确量取H2SO4溶液所用的玻璃仪器为________.
(2)步骤③中,加热蒸馏时间需长达30分钟,其目的为________.
(3)步骤④中,若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则所测n(NH4+)的值将________(填“偏大”、“偏小”或“不变”)。
Ⅱ.SO42-的测定
采用重量分析法,实验步骤如下:
①另准确称取19.60 g晶体X于烧杯中,加水溶解,边搅拌边加入过量的 BaCl2溶液;
②用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重.得沉淀质量23.30 g。
(4)步骤①中,判断 BaCl2溶液已过量的实验操作和现象是________。
(5)步骤②中,所用洗涤剂最合适的是________(填选项字母)。
A.冷水 B.稀硫酸 C.滤液
(6)步骤③灼烧操作中,除三脚架外,还需要用到下列仪器中的____(填选项字母)。
A.烧杯
B.坩埚
C.表面皿
D.泥三角
E.蒸发皿
F.酒精灯
(7)综合实验I、Ⅱ,通过计算得出晶体X的化学式为________。
某研究性学习小组将一定浓度的Na2CO3溶液滴入MgSO4溶液中得到白色沉淀。甲同学认为两者反应只生成MgCO3一种沉淀;乙同学认为这两者相互促进水解,只生成Mg(OH)2一种沉淀;丙同学认为生成MgCO3和Mg(OH)2两种沉淀。(查阅资料知:MgCO3和Mg(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和MgSO4溶液反应的化学反应方程式为_____________________________;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为①过滤 ②洗涤 ③干燥。
(2)请用下图所示装置,选择合适的实验装置和必要的试剂,证明沉淀物中只有碳酸镁。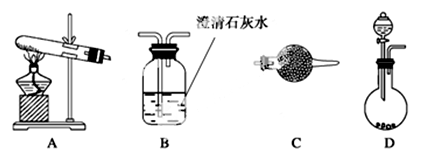
①各装置连接顺序为________________(用装置编号表示);②装置C中装有试剂的名称是______________;
③能证明生成物中只有MgCO3的实验现象是_______。
(3)若Mg(OH)2和MgCO3两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。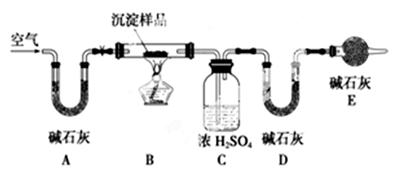
①实验结束时通入过量的空气的作用是________________________。
②A装置和E装置的共同作用是__________________________。
③实验过程中测定的数据有:W1:样品的质量,W2:反应后装置B中残渣的质量,W3:反应生成水的质量,W4:反应生成二氧化碳的质量,为了测定其组成,至少需要其中个数据,请将可能的组合填入下表中(每个空格中填一种组合,至少填5个)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)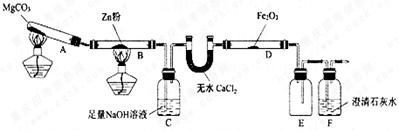
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题9图装置还可采取的改进措施是_____________________________。
(14分)氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃。在空气中强烈发烟,易与水发生水解反应。人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能。在熔融的硫中通入氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)已知S2Cl2分子结构与H2O2相似,请写出S2Cl2的电子式。
(2)装置a中应放试剂为,其作用为;装置c为何水平放置;
(3)该实验的操作顺序应为(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(4)f装置中应放置的试剂为 ,其作用为。
(5)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式。
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在中,再加水稀释,这样操作的目的是。
(2)装置C的作用是。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、、自然干燥,在这一系列操作中没有用到的仪器有(填序号)。
| A.蒸发皿 |
| B.石棉网 |
| C.漏斗 |
| D.烧杯 |
E.玻璃棒
F.坩埚
(4)根据以上现象,该小组同学认为SO2与 FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式;
②请设计实验方案检验有Fe2+生成;
③该小组同学向C烧杯反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42—。该做法(填“合理”或“不合理”),理由是。
(5)能表明I-的还原性弱于SO2的现象是。
Ⅰ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A、萃取分液法 B、渗析 C、结晶法 D、分液法 E、蒸馏法 F、过滤法
(1)分离饱和食盐水和沙子的混合物
(2)从硝酸钾和氯化钠的混合溶液中获得硝酸钾
(3)分离水和苯的混合物
(4)分离四氯化碳(沸点为76.75°C)和甲苯(沸点为110.6°C),已知四氯化碳和甲苯互溶。
Ⅱ.(1)指出下图装置中A、B的名称
AB
(2)分液操作中用到的主要仪器是。