【化学——选修《物质结构与性质》】
I.信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):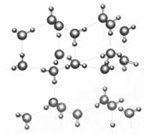
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为________.
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________.
A.金刚石 B.干冰 C.食盐 D.固态氨
(3)已知:2H2O H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________.
II.A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
(1)A、C形成的化合物________(填序号).
①一定属于离子化合物
②一定属于共价化合物
③可能属于离子化合物,也可能属于共价化合物
(2)C原子的电子排布式为________.
(3)若A元素的原子最外层电子排布为1s1,写出A、C形成的含有配位键的一种微粒符号________.
(4)当n=2时,每个BC2中含有________个σ键,________个π键.当n=3时,B与C形成的晶体类型为________.
(5)若D元素与Fe形成某种晶体,该晶体的晶胞如图所示.则该晶体的化学式是________(用元素符号表示);若晶胞的边长为a nm,则合金的密度为________g/cm3.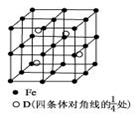
由短周期元素组成的X、Y、Z、M是中学化学常见的四种物质,它们有如图所示的转化关系,请根据题意回答问题。
(1)若X、Y、Z含有同种常见金属元素,M是O2。X为___________;Z与氢气在一定条件下化合生成一种产物,写出该反应的化学方程式________。
(2)若X、Y、Z含有同种常见非金属元素,气体Z能使品红溶液褪色。
①X的电子式为__________________ _______;
_______;
②Z与过量的氢氧化钠溶液反应的离子方程式是:_____________________________。
(3)若X的水溶液显碱性,X、M 均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
均为气体,上述转化过程均在水溶液中进行。任写一个满足上述转化过程Y→Z反应的化学方程式______________________。
已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.9 4 4 |
9 |
1 |
请回答下列问题:
(1)上述可逆反应中Q0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
①0~4 min的平均反应速率v(CO)="______" mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题:
(1)a电极作______极(填“正”、“负”或“阴”、“阳”),其电极反应式为_________________;
(2)反应一段时间后,电解质溶液的PH将(填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH=" —92.4" kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH=" —483.6" kJ·mol-1,试写出氨气完全 燃烧生成气态水的热化学方程式:__________________________;
燃烧生成气态水的热化学方程式:__________________________;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_________L(标准状况)。
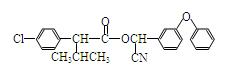
现用如下方法合成高效、低毒农药杀灭菊酯() :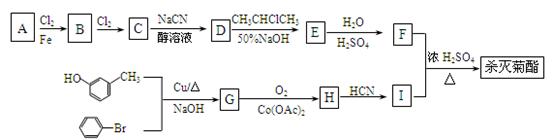
(1)F分子式为_____________________;合成G的反应类型是______________。
(2)有关A的下列说法正确的是__________(填序号)。
a.A是苯的最简单的同系物
b.A的核磁共振氢谱有5个峰
c.燃烧等物质的量A和环己烷消耗氧气的量相等
d.A的所有原子可能处在同一平面上
e.A不能使酸性KMnO4溶液褪色
(3)写出反应B→C的化学方程式(注明反应条件):_________________________。
(4)写出C在足量的氢氧化钠水溶液条件下发生充分反应的化学方程式:__________________
(5)D在硫酸存在下发生水解生成J:D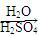 J
J
写出符合下列要求的J的所有同分异构体的结构简式(可以不填满):
________、________、________、_________、__________。
①苯环上有两个位于间位的取代基;
②能水解成两种有机物。
(6)α-氨基酸X与I互为同分异构体,且X是萘(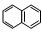 )的一取代物,含有碳碳叁键。写出由X通过肽键连接而成的高聚物Y的结构简式是。
)的一取代物,含有碳碳叁键。写出由X通过肽键连接而成的高聚物Y的结构简式是。
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下: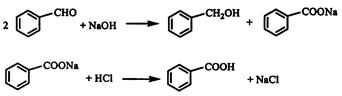
已知:
①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)。
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸。
③石蜡油沸点高 于250℃
于250℃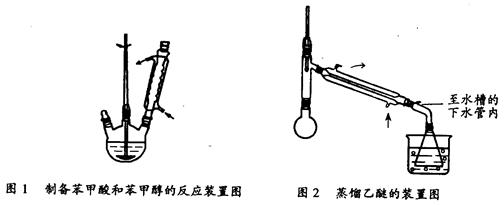
实验步骤如下:
① 向图l 所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20 mL,摇动均匀,冷却至室温。反应物冷却至室温后,用乙醚萃取三次,每次10 mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤,分液水层弃去所得醚层进行实验③。
③将分出的醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2 所示蒸馏装置,先缓缓加热,蒸出乙醚;蒸出乙醚后必需改变加热方式,升温至140℃时应对水冷凝管冷凝方法调整,继续升高温度并收集203℃~205℃的馏分得产品A。
④实验步骤②中保留待用水层慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤②萃取时用到的玻璃仪器除了烧杯、玻璃棒外,还需(仪器名称),实验前对该仪器进行检漏操作,方法是________________________________。
(2)饱和亚硫酸氢钠溶液洗涤是为了除去,而用碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。醚层中少量的苯甲酸是从水层转移过来的,请用离子方程式说明其产生原因___________________________。
(3)步骤③中无水硫酸镁是剂;产品A为
(4)蒸馏除乙醚的过程中采用的加热方式为;蒸馏得产品A加热方式是_______________;蒸馏温度高于140℃时应改用_________________冷凝。
(5)提纯产品B 所用到的实验操作为。