(14分)工业上以软锰矿(主要成分MnO2)为原料,通过液相法生产KMnO4。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到的K2MnO4,再用惰性材料为电极电解K2MnO4溶液得到KMnO4,其生产工艺简略如下: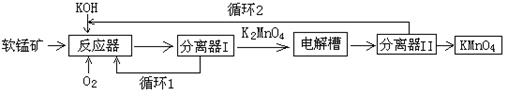
(1)反应器中反应的化学方程式为 。
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、Si的氧化物含量较高,会导致KOH消耗量 (填“偏高”或“偏低”)。
(3)电解槽中阳极的电极反应方程式为 。
(4)在传统工艺中得到K2MnO4后,向其中通入CO2反应生成黑色固体、KMnO4等,反应的化学反应方程式为 。根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为 。与该传统工艺相比,电解法的优势是 。
(5)用高锰酸钾测定某草酸结晶水合物的纯度:称量草酸晶体样品0.250g溶于水,用0.0500mol·L-1的酸性KMnO4溶液滴定(杂质不反应),至溶液呈浅粉红色且半分钟内不褪去,消耗KMnO4溶液15.00 mL,则该草酸晶体的纯度为________。(已知该草酸结晶水合物H2C2O4·2H2O的式量为126)
(16分) 研究发现铜具有独特的杀菌功能, 能较好地抑制病菌的生长。现有工业上由辉铜矿石(主要成分Cu2S)的冶炼铜两种方案:
Ⅰ 火法炼铜在1200℃发生的主要反应为:
①2Cu2S+3O2=2Cu2O+2SO2 ②2Cu2O+Cu2S= 6Cu+SO2↑
此方案的尾气可以用表中方法处理
| 方法1 |
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫,其部分热化学方程式为: 2CO(g)+SO2(g)= S(g)+2CO2(g) ΔH="+8." 0 kJ·mol-1 2H2(g)+SO2(g)= S(g)+2H2O(g) ΔH="+90." 4 kJ·mol-1 |
| 方法2 |
用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸 |
Ⅱ“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石,溶液酸性又进一步增强,过滤未溶解完的辉铜矿石,在滤液中加入足量的铁屑,待反应完全后过滤出铜和剩余的铁屑,得溶液Xml(设整个过程中其它杂质不参与反应,不考虑溶液离子水解)。其流程如图:
(1)Ⅱ相对于Ⅰ的优点是______________________________。(说一点即可)
(2)Ⅰ中反应2Cu2O+Cu2S= 6Cu+SO2↑氧化剂是________
(3)已知CO的燃烧热283. 0 kJ·mol-1,写出S(g)与O2(g)反应生成SO2(g)的热化学方程式___________。
(4)若用Ⅰ中方法2吸收尾气,则开始时阳极的电极反应式为________________。
(5)写出Ⅱ中黄铁矿氧化过程的化学反应方程式______________________________
(6)假设Ⅱ中每一步都完全反应,消耗掉标况下空气5×22.4VL(氧气体积分数为20%),则所得c(Fe2+)=________________(可以写表达式)。
研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
已知:① 2R-COOH + 2Na → 2R-COONa + H2 ↑
② R-COOH + NaHCO3 → R-COONa + CO2↑ + H2O
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为 。] |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团。 |
(4)A的核磁共振氢谱如下图: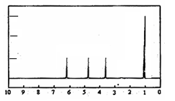 |
(4)A中含有 种氢原子。 综上所述, A的结构简式为 。 |
碳氧化物的转化有重大用途,回答关于CO和CO2的问题。
(1)己知:①C (s) + H2O(g) CO (g) +H2 (g)△H1
CO (g) +H2 (g)△H1
②2CO(g) + O2(g) = 2CO2 (g) △H2
③H2O (g)= H2 (g) +1/2 O2 (g) △H3
则C (s) + O2 (g) =CO2 (g)的△H = (用△H1、△H2、△H3表示)。
(2)对于化学平衡①,在不同温度下,CO的浓度与反应时间的关系如图所示,
由图可得出如下规律:随着温度升高,① ;② 。
(3)某温度下,将6.0 mol H2O(g)和足量碳充入3 L的恒容密闭容器中,发生如下反应:C(s) + H2O(g) CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
CO(g) +H2 (g),达到平衡时测得lgK=-1.0(K为平衡常数),求平衡时H2O(g)的转化率?(写出计算过程)
(4)在神州九号飞船中,宇航员呼出的CO2也可以采用Na2O2吸收,写出相关的化学方程式并标明电子转移的方向和数目: 。
2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g)ΔH=+67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g)ΔH=-534.0kJ·mol-1
2NO2(g)  N2O4(g)ΔH=-52.7kJ·mol-1
N2O4(g)ΔH=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g)ΔH=Q kJ·mol-1
4NH3(g)+3O2(g)ΔH=Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。
②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。
①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。