【化学——选修2:化学与技术】丙酮和苯酚都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm﹣3) |
沸点/℃ |
|
| 苯酚 |
94 |
1.0722 |
182 |
|
| 丙酮 |
58 |
0.7898 |
56.5 |
|
| 异丙苯 |
120 |
0.8640 |
153 |
|
回答下列问题:
(1)反应①和②分别在装置 和 中进行(填装置符号).
(2)反应②为 (填“放热”或“吸热”)反应.反应温度控制在50﹣60℃,温度过高的安全隐患是 .
(3)在反应器A中通入的X是 .
(4)在分解釜C中加入的Y为少量浓硫酸,其作用是 ,优点是用量少,缺点是 .
(5)中和釜D中加入的Z最适宜的是 (填编号.已知苯酚是一种弱酸)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 .
(7)用该方法合成苯酚和丙酮的优点是 .
A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物质已略去)。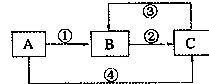
(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应①、反应④;
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A;C→B;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应③可能的离子方程式:③,写出A的化学式。
在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
(1)用SO2表示0~4 min内该反应的平均速率为。该温度下反应的平衡常数K为。升高温度K值(填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率(填“升高”、“不变”或“降低”),SO3的体积分数(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
(Ⅰ)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
;K值大小与温度的关系是:温度升高,K值
(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(Ⅱ)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
其化学平衡常数K和温度t的关系如下表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。
(2)该反应为反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是(多选扣分)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.υ正(H2)=υ逆(H2O)D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(5)某温度下,将CO和水蒸气各1mol置于密闭容器中反应,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量的范围是__________。
电解原理在化学工业中有广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是,
在X极附近观察到的现象是。
②Y电极上的电极反应,
检验该电极反应产物的方法是。
(2)若X和Y仍均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为_____
_________________________。通过一段时间后,向所得溶液中加入16gCuO粉末,恰好恢复到电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________。
(3)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是___________,电极反应式是_________________________。
②Y电极的材料是___________,电极反应式是_________________________。
(说明:杂质发生的电极反应不必写出)
在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 将(填“增大”、“减小”或“不变”);
将(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因
,此时溶液中各离子浓度由大到小的顺序为;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式。