X、Y、Z、W、R均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子的3d轨道为半充满状态,新制备的R的氢氧化物悬浊液可用于检验醛基的存在。请回答下列问题:
(1)X2分子中σ键和π键数目比是 ;
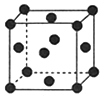
(2)R的晶胞结构如图所示,该晶胞中所含的原子个数是 ;
(3)下列有关X、Y、W的说法正确的是 ;
①第一电离能的排序是Y>X>W
②常温下,Y的氢化物分子间存在氢键
③XY3一中X的杂化轨道类型为sp3杂化
④W属于d区的元素
(4)X的气态氢化物分子的空间构型为 ,将其水溶液滴入R的氢氧化物悬浊液中,反应的离子方程式为 ;
(5)将Na2Y2与W2+的硫酸盐按物质的量之比为1:1混合并投入水中,溶液中出现红褐色沉淀并有无色气体产生,该反应的离子方程式是 。
【原创】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。另有元素R是用途最广泛的金属。
(1)W元素在周期表中的位置为 ;写出Y元素原子的价电子排布式: 。
(2)由X、Z两元素可以组成A、B两种化合物,A在一定条件下可以分解成B,A的电子式 。
(3)X、Y两元素按原子数目比3∶l和4∶2构成分子C和D,C的空间构型为 ,D—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,则D—空气燃料电池放电时,负极的电极反应式是: 。
(4)一定条件下,Y的单质气体与X的单质气体充分反应生成6.8g YX3气体,可放出18.44 kJ热量,则该反应的热化学方程式为 。
(5)科学家通过X射线探明,RO的晶体结构与NaCl的晶体结构相似,若在RO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3。则阿伏伽德罗常数NA表达式为 mol-1。
【物质结构与性质】A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3)DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,该配位化合物X的化学式为_________。
(6)Sb的一种氧化物高于843K时会转化为长链的大分子,其结构片段如图,则该分子中Sb和O的原子个数比为_______。
【化学与技术】海洋是一个巨大的化学资源宝库,下图是海水加工的示意图: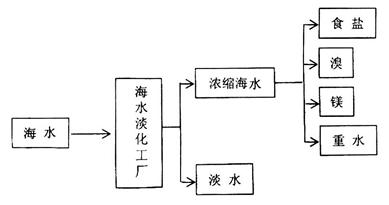
(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴的流程图。写出下图中试剂A的化学式 ,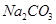 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
(3)制备金属镁是通过电解熔融的 ,而不用MgO,其原因是 。
,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和Cl2。海水中得到的粗盐往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,阳离子交换膜的作用是 。
【改编】【物质结构与性质】有A、B、C、D、E五种元素(A、B、C、D、E分别代表元素符号),其中A元素原子核内只有一个质子;B元素的基态原子s亚层的总电子数比p亚层的总电子数多1;C元素的原子最外层电子数是次外层电子数的3倍;D位于B的下一周期,在同周期元素形成的简单离子中,D形成的简单离子半径最小;E的基态原子中电子排布在三个能级上,且这三个能级所含电子数均相同。
(1)A、E形成的化合物E2A4每个分子中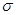 键和
键和 键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为_________ (用实际元素符号表示)。
键数目之比为________,B、C、E三种元素的第一电离能由大到小的顺序为_________,电负性由大到小的顺序为_________ (用实际元素符号表示)。
(2)BA3易液化的主要原因是__________________。 离子中B原子轨道的杂化类型为__________,离子空间构型为 。
离子中B原子轨道的杂化类型为__________,离子空间构型为 。
(3)写出D元素基态原子的核外电子排布式______________。
(4)E的一种单质晶胞结构如图,晶胞的边长为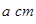 。该晶体的密度为________
。该晶体的密度为________ g(NA表示阿伏加德罗常数,E的相对原子质量为b)。
g(NA表示阿伏加德罗常数,E的相对原子质量为b)。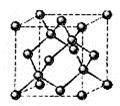
【化学与技术】工业上以黄铁矿为原料,采用接触法生产硫酸。请回答下列问题:
(1)煅烧黄铁矿的设备名称是__________,进料前必须将黄铁矿粉碎,目的是________。所得炉渣的用途有__________________________(填一种用途)。
(2)进入接触室前的气体必须经过净化处理,目的是防止________________________________。
(3)生产过程中,吸收三氧化硫常用的物质是_____________________________。
(4)温度变化与二氧化硫转化率的变化关系可用下图中的曲线______(填“a”或“b”)表示。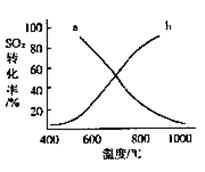
(5)工业上常用熟石灰和硫酸处理、回收尾气中的有害气体。反应的化学方程式为:
________________________________、_________________________________。