(15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、速凝于一体的新型多功能水处理剂。其生产流程如下:
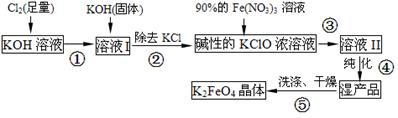
(1)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度是 mol/L。
(2)在溶液I中加入KOH固体的目的是 (填编号)。
| A.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使副产物KClO3转化为 KClO |
(3)每制得59.4克K2FeO4,理论上消耗氧化剂的物质的量为 mol。从溶液Ⅱ中分离出K2FeO4后,还得到副产品KNO3、KCl,写出③中反应的离子方程式: 。
(4)高铁酸钾(K2FeO4)溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生,该反应的离子方程式是 。
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图2所示。电解过程中阳极的电极反应式为 。

实验室制NO及验证NO的性质,可以用如图所示的装置。请根据提示完成以下问题。已知反应:

1.NO的制备
(1)在加药品之前首先应进行的操作是(填操作名称),
(2)打开阀门K,取下活塞J向其中加入一小片铜片,装上活塞并推至底部。
(3)用注射器吸取适量的蒸馏水,然后倒立针筒,推动活塞J至底部以排尽装置内空气(装置内极少量的水不影响实验)。
(4)将注射器插入稀 中,吸取适量的
中,吸取适量的 稀
稀 ,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
,然后迅速关闭阀门K,请回答此时可能观察到的实验现象:。
反应的离子方程式为: ,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
Ⅱ.NO性质实验
(1)观察注射器内气体呈色,然后打开K,吸取适量空气后关闭K,此时注射器内气体呈色,反应的化学方程式为:。
(2)向下快速推动活塞J,注射器内气体颜色变化情况为:,原因是(结合化 学方程式并配以必要的文字说明)。
学方程式并配以必要的文字说明)。
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是 。
a.把过量的铁粉与稀HNO3反应
b.把铁粉与过量的稀HNO3反应
c.先把铁粉灼烧,再溶解于稀HNO3 中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+。
检验Fe2+的方法: ,甲同学观察到的实验现象为: ,
甲同学检验出Fe2+,验证了假设1的成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法)。
| 实验步骤(不要求写具体操作过程) |
预期现象和结论 |
| ① |
若银镜消失,假设②成立。 若银镜不消失,假设②不成立。 |
| ② |
【思考与交流】
⑷甲同学验证了假设1成立,若乙同学验证了假设2成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你 (填“是”“否”)同意丙同学的结论,并简述理由: 。
(16分) 某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验

 【实验一】收集NO气体。
【实验一】收集NO气体。 (1)用装置A收集NO气体,正确的操作是(填序号)。
(1)用装置A收集NO气体,正确的操作是(填序号)。 a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气 c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气 【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
(2)请参照装置A,画出净化Cl2装置图,标明所盛的药品,标注气体的流动方向。
【实验三】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用NaOH溶液作试剂,拟出下列实验方案并进行相关实验。 方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
(3) 选用和(填仪器标号)两个装置进行实验。
选用和(填仪器标号)两个装置进行实验。
(4) 测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=。
测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=。
(5) 计算镀层厚度,还需要检索的一个物理量是。
计算镀层厚度,还需要检索的一个物理量是。
(6) 若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。
若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将(填“偏大”、“偏小”或“无影响”)。 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g ;
;
(7)w(Zn)=。
(12分)某同学准备用CuSO4·5H2O配制480 mL 1 mol/L的溶液。
⑴该同学选用的容量瓶容积的规格是mL;
⑵玻璃棒在该实验中有重 要的用途,分别是和;
要的用途,分别是和;
⑶配制好的溶液呈 色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
色。该同学还想通过实验分别证实溶质中含有Cu2+、SO42-,请你帮他想想办法,选择适当的试剂(写化学式),并写出其相应的离子方程式。
| 溶质 |
加入试剂 |
离子方程式 |
| Cu2+ |
||
| SO42- |
⑷物质的量浓度误差分析:(填偏高、偏低、无影响)
①若容量瓶洗净后未干燥,残留少量水,则所配制的溶 液浓度将
液浓度将 ;
;
②定容时,若眼睛俯视,则所配制的溶液浓度将。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。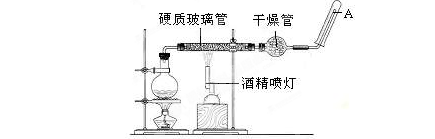
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是,氧化剂是,假设有1mol氧化剂参加反应,转移的电子数的物质的量为。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(3)酒精灯和酒精喷灯点燃的顺序是,为什么?。
(4)干燥管中盛装是的物质是,作用是 。
。
(5)某次实验后,取硬质玻璃管中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因。