学习化学要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:

找出上述三组分类中的错误,错误物质的化学式为 。
(2)下列2个反应,按要求填写相关量。
①2Na2O2+ 2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成 g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是 (填代号)
A.NaOH B.AgNO3 C.HCl D.Na2SO4
(3)配平下面化学方程式,回答下列问题:

①H2SO4在上述反应中表现出来的性质是(填选项编号) .
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____L。
(4)在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:

该变化的基本反应类型是 反应,Q物质的作用为 。
下表是甲、乙、丙、丁四种有机物的有关信息;
| 甲 |
①能使溴的四氯化碳溶液褪色;②比例模型为: ③能与水在一定条件下反应生成丙 ③能与水在一定条件下反应生成丙 |
| 乙 |
①由C、H两种元素组成;②球棍模型为 |
| 丙 |
①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与丁反应生成戊 |
| 丁 |
①由C、H、O三种元素组成;②球棍模型为 |
根据表中信息回答下列问题:
(1)写出与甲互为同系物,且比甲多一个碳原子的有机物在一定条件下生成的高分子化合物的结构简式 ;
(2)乙与液溴反应的化学方程式为 ;
(3)丙与丁反应能生成戊,戊为相对分子质量为100的酯,该反应类型为 ,其化学反应方程式为 ;(4)写出一种符合下列条件的戊的同分异构体的结构简式: ;
I.分子中不含支链并能使溴的四氯化碳溶液褪色
II.能与NaHCO3溶液发生反应
请根据表中数据回答有关问题:
| 酸或碱 |
电离常数(Ka或Kb) |
难(微)溶物 |
溶度积常数 |
| CH3COOH |
1.8×10-5 |
BaSO4 |
1×10-10 |
| HNO2 |
4.6×10-4 |
BaCO3 |
2.6×10-9 |
| HCN |
5×10-10 |
CaSO4 |
7×10-5 |
| HClO |
3×10-8 |
||
| NH3·H2O |
1.8×10-5 |
(1)表中所列四种酸中,酸性最弱的是 (用化学式表示)。下列能使醋酸溶液中CH3 COOH的电离度增大,而电离常数不变的操作是 (填序号);
A.升高温度B.加水稀释
C.加少量的CH3 COONa固体D.加少量冰醋酸
(2)已知纯水在100℃时的pH=6。该温度下0. lmol/L的NaOH溶液中,pH为 ;
(3)常温下,向水中加入少量醋酸铵固体,所得溶液呈中性,简述其原因 ;
(4)工业中制BaCl2时,需先将BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,欲使SO42-物质的量浓度达到0.01 mol/L以上,则溶液中CO32-物质的量浓度应≥_______mol/L;
元素周期表中第3周期元素的单质及其化合物的用途广泛。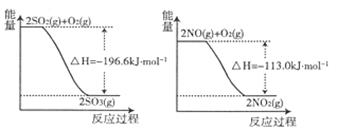
(1)该周期元素中,半径最小的简单离子的结构示意图为 ,最活泼金属元素和最活泼非金属元素形成的化合物的电子式为 ;
(2)氯的氧化物具有强氧化性,其中ClO2可将弱酸性废水中的Mn 2+转化为MnO2而除去,同时ClO2被还原为Cl--,该反应的离子方程式为 ;
(3)已知SO2,NO分别与O2反应过程中能量变化如图所示:写出NO2和SO2在一定条件下发生反应的热化学方程式 。
某化学研究性学习小组的同学在学习了电化学相关知识后,将所学知识整合得到如图所示装置,用于电解饱和食盐水。
请回答下列问题:
(1)甲池中Al极为 极,乙池中C2极为 极;
(2)甲池中发生反应的总化学方程式为 ;
(3)若向乙池中滴加酚酞试液,则C1极附近观察到的现象为 ,C2极的电极反应式为 ;
(4)当C1极析出224mL气体(标准状况)时,转移电子的物质的量为 。
(14分)丙烯酸乙酯(Ⅳ)是合成塑料、树脂等高聚物的重要中间体,可由下面路线合成:
(1)反应②属于 反应,1molⅣ完全燃烧消耗O2为 mol.
(2)Ⅱ含有的官能团名称为 ,Ⅱ能使溴水褪色,其反应方程式为 .
(3)Ⅰ可以由Ⅴ(分子式为C3H6O)催化氧化得到,则Ⅴ→Ⅰ的反应方程式为 (注明反应条件).
(4)Ⅵ是Ⅳ的一种无支链的同分异构体,且碳链两端呈对称结构.则Ⅵ的结构简式为 .
(5)一定条件下,化合物  也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .