Al、Fe、Cu是生活中常见的金属,也是应用最广泛的金属。请回答下列问题
(1)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_____
向反应后的溶液中通入过量CO2,反应的离子方程式为_______________
(2)铁的复杂氧化物Fe3O4溶于稀硫酸生成两种盐,则反应的化学方程式为_________
检验反应后的溶液中存在Fe2+的具体操作是________________
纳米级Fe3O4是一种吸附剂,在溶液中可发生如下反应:Fe3O4+H2O+O2→Fe(OH)3,每转移1mol电子生成Fe(OH)3的物质的量为_________。
(3)2.50 g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
Ⅰ.试确定b点时固体物质的化学式____________(要求写出必要的推理过程);
Ⅱ.取270℃所得样品,于770℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为_____________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为__________。Ⅲ.1000℃发生反应的化学方程式为_____________。
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用。
(1)请在下图的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。
(2)从能量转换的角度看,过程Ⅱ应是_________能转化为_________能。
(3)该燃料电池中以KOH溶液作电解质溶液,请写出该电池的电极反应式:
负极____________________________________;
正极____________________________________。
该燃料电池的优点为
列几组物质中,互为同位素的有__________,互为同素异形体(同一种元素形成的不同的单质)的有________,互为同系物的有____________,互为同分异构体的有____________________,属于同种物质的有__________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3④CH3CH2CH(CH3)CH2CH3和
CH3CH2CH(CH3)CH(CH3)CH3
⑤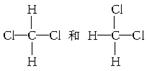
⑥CH3(CH2)2CH3和(CH3)2CHCH3⑦CH3CH(CH3)CH3和CH(CH3)3
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为______。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是______(写化学式),
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有______(写出其中两种物质的化学式)。
(4)ZX的电子式为______;ZX与水反应放出气体的化学方程式为________________________________________________________________________。
前四周期元素W、X、Y、Z的原子序数依次增大,W的原子最外层电子数是次外层电子数的3倍。X、Y和Z分属不同的周期,他们的原子序数之和是W原子序数的5倍。W可以与Y组成YW型化合物。请回答下列问题:
(1)W元素原子的L层电子排布式为,W3分子中的化学键类型;
(2)X单质与水发生主要反应的化学方程式为;
(3)X的氢化物沸点与同主族下一周期的元素的氢化物的沸点比较,沸点较高的是 ( 用化学式表示)原因是
(4)含有元素Z的盐的焰色反应为色。许多金属的盐都可以发生焰色反应,其原因是。
根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(2)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(从A B C中选择)。
A.能量最低原理 B.泡利原理 C.洪特规则
(3)依据正负化合价代数和等于0,H元素可以放在周期表中的族
(4)氯化铵的电子式