(10分,每空2分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池,已知H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1、-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解180 g水消耗的能量是 kJ。
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):


下列说法正确的是 (填序号)
①温度为T1时,从反应开始到平衡,甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时(甲醇为气态),将lmol CO2和3mol H2充入一密闭恒容容器中充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为 ;
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为 。
淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质。按要求回答下列问题:
(1)水质优劣直接影响人体健康。天然水在净化处理过程中加入的混凝剂可以是___________(填一种物质的名称),其净水作用的原理是_________________________ ____。混凝剂难以清除溶解于水中的有机物、无机物、微生物,混凝剂沉淀后还需要_____________。
(2)硬水的软化指的是_________________________ ____________________________ ___。
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为_____________。
(4)若(3)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2____________g, 后加入Na2CO3___________g 。
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极。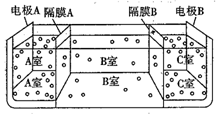
①隔膜A是_________(填“阴”或“阳”)离子交换膜。
②某种海水样品,经分析含有大量的Na+、Cl-,以及少量的K+、SO42-。若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为________________________。
可逆反应mA(g)+nB(g) pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
pC(g)+ qD(g)△H="a" KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。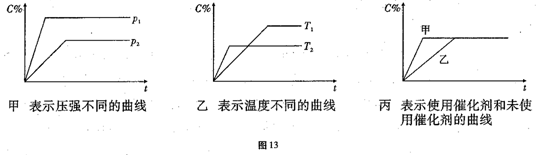
(1)据上述信息试比较下列大小关系:P1_______ P2,T1_______T2,△H_____0,△S_____0(增色填“﹥”“﹤”或“=”),图丙中使用催化剂的是_______反应线。
(2)该反应在_______(填“高温”或“低温”)下能自发进行。
(3)当该反应在两个体积相等的恒容密闭容器中进行反应时,如图:
请分析丙容器和丁容器达到平衡时C%(产物C的体积分数)是否可能相等,_____ (填“能”或“不能”),其原因是_____ _____ _____ 。
(4)假设第(3)问中,图中物质的量不变,在相同温度下达到平衡时丁中A、B的浓度分别是丙中A、B的浓度的ω倍,求m:n的值为 。
磷化铝是用红磷和铝粉烧制而成。因杀虫效率高、经济方便而应用广泛。可作粮仓熏蒸的磷化铝片,熏蒸每吨粮食只需3~5片(3.20g/片)。
(1)写出磷化铝的化学式:________;举一例红磷的同素异形体,写出其化学式:________。
(2)磷化铝毒性主要为遇水、酸时则迅速分解,放出吸收很快、毒性剧烈的磷化氢气体,写出磷化铝
和水反应的化学方程式:____________________________________________________________。
(3)磷化氢是一种无色、剧毒、易燃的气体,该气体比空气重并有类似臭鱼的味道,其结构和NH3相似,写出磷化氢的电子式:________;磷化氢具有强的还原性,通入硫酸铜溶液中会生成单质铜和磷酸,写出该反应的离子方程式:___________________________________________。
(4)磷化氢在空气中的最高允许值为0.3ppm,空气中超标的PH3气体可以用重铬酸钾、活性炭、氢碘酸处理,你认为他们的反应原理是否相同,原因是____________________________________。
(5)磷的含氧酸很多,H3PO4是常见的一种,多个磷酸分子通过脱水作用由O原子连接而成为多磷酸,三聚磷酸钠(Na5P3O10·6H2O)是常见的多磷酸盐,该盐373K时,可发生如下反应Na5P3O10·6H2O="==" Na3HP2O7+X+5H2O,请你推出X的化学式:__________________;并且写出X溶液中离子电荷守恒的等式:___________________________。
废旧显示屏玻璃种含有SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O],流程设计如下:
已知:Ⅰ.酸性条件洗,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于氢氧化钠溶液。
回答以下问题:
(1)反应②中过氧化氢的作用是 。
(2)反应③的离子方程式是 。
(3)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2 Ce3+(水层)+6HT(有机层) ≒2 CeT3 (有机层) +6H+(水层)
从平衡角度解释:向CeT3(有机层)加入硫酸获得较纯的含Ce3+的水溶液的原因是 。
(4)硫酸铁铵矾[Fe2(SO4)3·(NH4)2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(5)相同物质的量浓度的以下三种溶液中,铵根离子浓度由大到小的顺序是 。
a.Fe2(SO4)3·(NH4)2SO4·24H2O b.(NH4)2SO4 c.(NH4)2CO3
(6)用滴定法测定制得的Ce(OH)4产品纯度。
若所用硫酸亚铁溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”);称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量氢氧化钠溶液,过量洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L硝酸钡溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合氢离子能力最强的是 ,根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:
① ② (填“>”“=”“<”下同)。溶液中阴离子的物质的量浓度之和:① ②。
(3)碳酸氢钠是一种 (填“强”或“弱”)电解质;写出HCO3-水解的离子方程式: ,常温下,0.1mol/L碳酸氢钠溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH-五种微粒的浓度由大到小的顺序为: 。
(4)实验室中常用氢氧化钠来进行洗气和提纯。
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为: 。
② 几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度的Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)3]
Ksp[Mg(OH)2] (填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
( Ksp[Cu(OH)2]=2×10-20mol2/L2)