今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到0.08mol气体;
第三份加入足量BaCl2溶液后,得到干燥沉淀12.54g,经足量的盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl- ,
(2)由第二份进行的实验可知混合物中应含 离子,其物质的量浓度为 。
(3)由第三份进行的实验可知12.54g 沉淀的成份为 。请计算形成该沉淀的原混合物中各离子的物质的量 。
(4)综合上述实验,你认为以下结论正确的是
| A.该混合物中一定含有K+、NH4+、CO32-、SO42-,可能含有Cl-,且n(K+)≥0.04mol |
| B.该混合物中一定含有NH4+、CO32-、SO42-,可能含有Ca2+、 K+、Cl- |
| C.该混合物中一定含有NH4+、CO32-、SO42-,可能含有K+、Cl- |
| D.该混合物中一定含有NH4+、SO42-,可能含有Ca2+、K+、Cl- |
(3分,每空1分)人们对苯及芳香烃的认识有一个不断深化的过程。
(1)已知分子式为 C6H6 的结构 有多种,其中的两种为
有多种,其中的两种为
1 mol C6H6 与H2加成时:Ⅰ需______mol,而Ⅱ需 _______mol。
(2)今发现 C6H6还可能有另一种如上图立体结构:该结构的二氯代物有_______种。
(6分,每空1分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合(氢原子省略)。回答下列问题: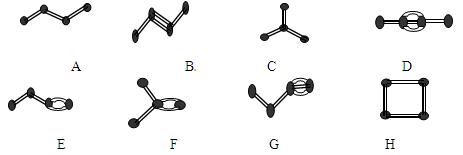
(1)图中属于链状烷烃的是(填编号)
(2)写出上图中B、C的结构简式 B、C
(3)与A互为同分异构体的 是(填编号)
是(填编号)
(4)用系统命名法对下列烷烃进行命名:
①(CH3)2CHC(C2H5)2C(CH3)2C2H5②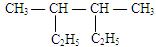
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3mol SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为。(1分)
SO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol , 则达到平衡时SO2的转化率为。(1分)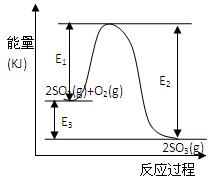
(2)下列叙述能证明该反应已达化学平衡状态的是(填序号)(2分)
①SO2的体积分数不再发生变化②容器内压强不再发生变化③容器内气体分子总数不再发生变化④相同时间内消耗2n molSO2的同时生成n molO2⑤相同时间内消耗2n molSO2的同时生成2n mol SO3
SO3
(3)反应(填“放出”或“吸收”)热量(用E1、E2或E3表示)(2分)。
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。
写出两电极的电极反应式: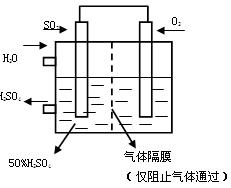
;。(2分) [来网]为稳定持续生产,硫酸溶液的浓度应维持不变,则通入S O2和水的质量比为(2分)
O2和水的质量比为(2分)
(7分,每空1分)A、B、C、D为同一周期的四种元素,原子序数依次增大,已知0.2摩A与酸充分反应时,在标况下可生成2.24升氢气;B的氧化物既可溶于强酸又可溶于强碱溶液;C、D阴离子的电子层结构与氩原子相同,C的气态氢化物与C的低价氧化物反应,又可得到C的单质。试回答:
(1)A、B、C、D的元素符号分别为______、____、、______。
(2)用电子式表示A与C形成化合物的过程:
_________________________________________________。
(3)写出B的氧化物与A的氢氧化物反应的离子方程式:
_________________________________。
(4)写出实验室制备D的单质的化学反应方程式:
__________________________________________。
按已知的原子结构规律,82号元素X应是第___________周期___________族元素,它的最高正价氧化物的化学式为_____________(该元素的元素符号用X表示)。