【2015年江苏省泰州市】某校九(1)班同学举行“是真的吗?”化学主题活动,请你和蓓蓓一起探究。
话题1:能被磁铁吸引的物质一定是铁单质吗?
【实验验证】①将细铁丝在纯氧中完全燃烧,主要反应的化学方程式为 。
②将反应后的黑色固体用磁铁检验,能被吸引。
【实验结论】能被磁铁吸引的物质 (填“一定”或“不一定”)是铁单质。
话题2:含有Ba2+的盐一定有毒吗?
【社会调查】在医院检查胃肠疾病时,病人需服用“钡餐”(主要成分为BaSO4)。
【调查结论】“含有Ba2+的盐一定有毒”这句话是 (填“真的”或“假的”)。
【交流反思】若误服碳酸钡(BaCO3),胃酸的主要成分 (填化学式)会与之发生反应,形成可溶性钡盐,使人体内蛋白质变性而中毒,此时可服用 (填一种即可)解毒。
话题3:向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中一定含有SO42-吗?
【实验回顾】向硝酸银溶液中先滴加稀硝酸,再滴加氯化钡溶液,也产生白色沉淀,反应的化学方程式是 。
【实验结论】向某溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,若产生白色沉淀,原溶液中不一定含有SO42-。
【拓展实验】向硫酸钠溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,也产生白色沉淀。
【查阅资料】①硝酸具有强氧化性。向Na2SO3溶液中滴加稀硝酸时,发生如下反应:
2HNO3(稀)+3Na2SO3=3Na2SO4+2NO↑+H2O
②含有SO32-的盐统称为亚硫酸盐,亚硫酸盐都能与盐酸反应生成二氧化硫气体。
【交流反思】①向某一种钠盐溶液中先滴加足量稀硝酸,再滴加氯化钡溶液,产生白色沉淀。原溶液中阴离子可能是SO42-,还可能是 (填离子符号)。
②下列实验方案中,能证明溶液里含有SO42-的是 (填“A”或“B”)。
A.取样,先滴加氯化钡溶液,产生白色沉淀,再滴加稀盐酸,沉淀不溶解
B.取样,先滴加稀盐酸,无明显现象,再滴加氯化钡溶液,产生白色沉淀
某小型火力发电厂(以煤为燃料)排放大量的废气,对周围的空气产生了严重污染,并导致当地常降酸雨。为探究废气的成分,实验中学化学课外活动小组的同学将收集来的气体样品用如下装置进行实验。已知装置的连接顺序是丙→甲→乙,且其中的药品均足量。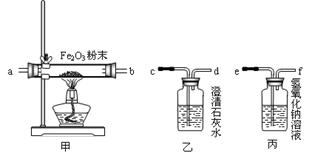
【猜想与假设】
A同学认为:废气中一定含有CO2
B同学认为:废气中可能含有CO
C同学认为:废气中可能含有SO2
【交流与评价】经过讨论,大家一致认为:电厂的燃煤中含有较多的硫元素或氮元素。请说明他们得出该结论的依据是。
【活动探究】在用上述装置进行的实验中,B同学的观点得到证实:废气中确实含有CO。那么丙装置的作用是什么?写出甲装置的玻璃管中反应的化学方程式。
探究燃烧条件的实验装置如图所示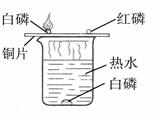
(1)由该实验得出,可燃物燃烧的另外两个条件是:、
(2)实验中使用了铜片,主要是利用铜的什么性质?
某化学兴趣小组用石灰石和盐酸反应制取CO2,并验证CO2的性质。在确认装置气密性良好后进行实验。把制得的气体通入澄清石灰水中,发现石灰水没有变浑浊。对此展开探究:
(1)【提出问题】澄清石灰水为什么没有变浑浊?
(2)【猜想与验证】
①甲同学认为可能石灰水已变质。他取少量澄清石灰水于试管中,向其中吹气,现象是__________,说明澄清石灰水没有变质。写出该反应的化学方程式。
②乙同学认为制得的CO2中可能混有HCl 。他作出此猜想的依据是__________
他用试管取少量紫色石蕊试液,再通入制得的气体,紫色石蕊试液变红,他得出结论是CO2中混有HCl 气体。
③ 丙同学认为乙同学的实验结论是错误的,理由是________________________
请你和他们一起设计实验证明:
| 实验步骤 |
实验现象 |
实验结论 |
| 用试管取少量AgNO3和稀HNO3的混合溶液,通入制得的气体 |
CO2中混有HCl 气体。 化学方程式 |
(3)【反思与评价】丁同学认为既然用盐酸会使制得的CO2不纯,何不用稀H2SO4代替盐酸。请问丁同学的想法对吗?_____,理由是__________________________
小亮对铁丝在氧气里燃烧时出现的红热球状物产生了兴趣,随后他进行了以下探究活动。
【问题1】铁燃烧后剩下来的球状物质中还有没有铁呢?
【实验探究】将剩下来的球状物质碾碎,加入溶液,观察到的现象是,说明铁燃烧时溅落下来的黑色物质中还含有铁。
【问题2】铁燃烧的产物为什么不是Fe2O3呢?
【查阅资料】
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(3)Fe2O3高温时分解成Fe3O4
【理论探讨】实验测定铁在氧气里燃烧的产物是Fe3O4,结合表中数据,可推知铁在氧气里燃烧时产生的高温应在℃之间,在此温度范围内已分解。
【拓展延伸】
(1)实验中为了防止集气瓶炸裂,必须;
(2)有些食品包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色,就说明包装盒破损进气,这样售货员就能及时发现并处理。
(8分)在学习盐的性质以后,某校化学兴趣小组的同学开展了测定Na2CO3和NaCl
的固体混合物中Na2CO3质量分数的探究实验。他们设计了如下方案:
【方案一】气体分析法。
(1)如下图1所示(铁夹夹持的仪器是注射器),把一定量的混合物与足量稀硫酸反
应后,测定产生CO2的体积,根据CO2的密度计算质量。实验前,向后拉注射器活塞,松开后,如果,则装置不漏气。
(2)有同学提出以图2代替图1中的收集装置,则所测CO2气体的体积(填“偏
大”、“偏小”或“不变”),原因是,你的改进方案是。
(3)也有人用图3装置进行测定,根据盛碱石灰的干燥管质量的增重确定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)。图3实验装置存在明显缺陷,缺陷之一是 __________。
【方案二】沉淀分析法(如图4所示)。则:
(1)试剂A可以是溶液(写一种),加入过量A是为了。
(2)把沉淀洗涤的目的是。