某化学兴趣小组的同学对空气中氧气的含量进行探究。
【提出问题】空气中氧气的含量是多少?
【查阅资料】①红磷和白磷都能在空气中燃烧,都生成五氧化二磷,但红磷的着火点(可燃物燃烧所需的最低温度)为240℃,白磷的着火点为40℃。
②氧化钙能与反应生成氢氧化钙,同时放出大量的热,能煮熟鸡蛋。
③生石灰的主要成分是氧化钙。
【设计方案】兴趣小组的同学将一个具有刻度和可滑动活塞的玻璃管(其中有空气和白磷)放在装有生石灰的烧杯的上方(如图所示),用此装置进行实验,请你一同参与。
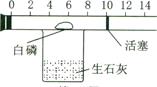
【进行实验】①检查图中玻璃管的气密性。其操作步骤、现象和结论是
②按图示装好药品后的操作是 该操作的作用是
【记录现象】实验过程中观察到的现象是
【实验结论】
【实验反思】本实验是对教材实验稍作改进而设计的,其主要优点是
【拓展与应用】已知, 据此反应能否用镁代替磷测定空气中氧气的体积含量?
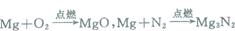
由此你对氮气的化学性质有何新的认识
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验。
| 实验编号 |
实验操作 |
实验现象 |
① |
分别在试管A、B中加入 5 mL 5%(溶液浓度) H2O2溶液,各滴入2 滴相同浓度的CuSO4溶液。待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡。 |
试管A中不再产生气泡; 试管B中产生的气泡量增大。 |
| ② |
另取两支试管分别加入5mL 5%H2O2溶液和5 mL 10%H2O2溶液 |
试管A、B中均未明显见到有气泡产生。 |
(1)过氧化氢分解的化学方程式为。
(2)实验①的目的是。
实验中滴加CuSO4溶液的目的是。
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你设计的实验方案是。(用实验中所提供的几种试剂)。
(4)对于H2O2分解反应,Fe2(SO4)3溶液也有一定的催化作用。为比较Fe2(SO4)3和CuSO4溶液对H2O2分解的催化效果。某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: 
如图所示,同学们分别从定性和定量角度进行了比较。
①定性分析:如图甲可通过观察,定性比较得出结论。
②定量分析:用图乙所示装置做对照试验,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是。
(5)通过对上述实验过程的分析,在实验设计时,要考虑_________方法的应用。
实验室中,利用下列装置可以制取某些气体,请回答下列问题。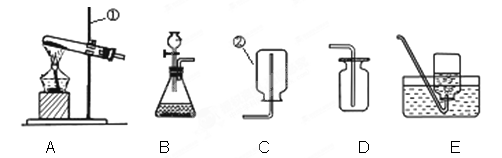
⑴写出带标号的仪器的名称:①;②。
⑵向气体发生装置内加入药品前,应该进行的操作是。
⑶实验室若用高锰酸钾制取氧气,选择的发生装置是;用双氧水制氧气的化学方程式为;
⑷能用C装置收集的气体,必须具备的性质是;
⑸乙炔又称电石气,是一种无色、无味、密度比空气略小,不溶于水的气体;工业上常用它燃烧产生的高温来切割和焊接金属;实验室用电石(固体)与水反应制取乙炔。你认为制取乙炔应选择的发生装置是;收集装置是(此空2分,回答不全将酌情扣分)。
根据下图所示装置回答问题:
(1)用A装置制取氧气,反应的化学方程式为。
(2)实验室若用B装置来制取二氧化碳时,往长颈漏斗中应加入。若用G来收集二氧化碳,二氧化碳应从进(选“a”或“b”)。
(3)制取二氧化碳最好选择的发生装置是(选择“B”或“C”),与另一个装置相比,其优点是:。
(4)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。实验室制取H2S气体时,发生装置应选用,收集装置应选用__________ (填仪器编号)。
(5)红旗水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)
有关实验数据如下表:
| 反应前 |
反应后 |
||
| 实验数据 |
烧杯和稀盐酸的质量 |
石灰石样品的质量 |
烧杯和其中混合物的质量 |
| 160 g |
12 g |
167.6 g |
求该石灰石中碳酸钙的质量分数。
天然气的主要成分是甲烷(CH4),我校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与:
【提出问题】 甲烷燃烧后生成哪些物质?
【查阅资料】 含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
【猜想与假设】甲: CO2 H2O乙: CO H2O
丙: NH3CO2 H2O 丁: CO2 CO H2O
你认为同学的猜想是错误的,理由是。
【实验探究】:为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
(1)A、B装置的顺序能否颠倒?(填“能”或“否”)。
(2)实验中用纯净O2而不用空气的原因是。
(3)实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断同学猜想成立。
(4)请写出C中红色粉末变成黑色的化学方程式:。
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是。
某化学小组利用下图所示装置测定铜锌合金样品中锌的质量分数(图中固定装置已略去)探究过程如下: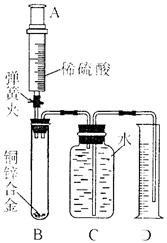
1.连接实验装置并检查装置气密性
Ⅱ.向B中加入质量为m的铜锌合金粉末,由注射器A向B缓缓加入稀硫酸,待B中不再有气体产生气体时,夹紧弹簧夹,立即移出D中导管,准确读取并记录量筒内水的体积。
Ⅲ.经过滤等操作,准确称量并记录B中剩余固体物质的质量。
IV.该小组的甲同学根据反应前后B中固体物质的质量计算样品中锌的质量分数;乙同学认定量筒内测得水的体积
即为反应生成气体的体积,并利用该气体在常温下的密度,根据化学方程式进行相关计算,得到样品中锌的质量分数。请回答下列问题:
(1)Ⅲ中,正确的操作顺序是:过滤、、、称量。
(2)通过误差分析,化学小组发现乙同学所用数据不可靠。造成该数据不可靠的原因及其对计算结果的影响是:
①II中,移出D中的导管内留存有水,导致计算结果偏小。
②。
(3)①日常生活中为方便使用通常将金属制成合金,伍角币为钢芯镀铜、一元币为钢芯镀镍(Ni)合金①铸造以上硬币用到的材料都是材料
②选择铸造硬币的材料不需要考虑的因素是(填序号)。
| A.金属的导电性 | B.金属的耐腐蚀性 |
| C.金属的硬度 | D.金属价格与硬币面值的吻合度 |
③以上硬币涉及到Fe、Cu、Al、Ni(镍),已知Ni能够发生如下反应:
Ni+ H2SO4=" Ni" SO4+ H2↑ Fe+ Ni Cl 2=" Ni" + Fe Cl 2
四种金属活动性由强到弱的顺序为(用元素符号表示)。