工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
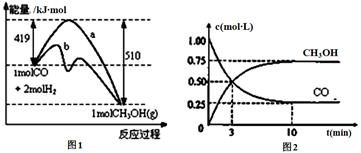
请回答下列问题:
(1)在“图1”中,曲线 (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H= 。
CH3OH(g)的△H= 。
(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)= ;达到平衡时,c(H2)= ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
CH3OH(g)的化学平衡常数表达式为 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡 移动 (填“正向”、“逆向”或“不”)。
(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol, 又知H2O(l)= H2O(g);ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
Ⅰ.铁是当代社会中用量最大的金属之一。已知:
①Fe3O4(s)+4C(石墨) 3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
3Fe(s)+4CO(g) ΔH=+646.0 kJ/mol
②C(石墨)+CO2(g) 2CO(g)ΔH=+172.5 kJ/mol
2CO(g)ΔH=+172.5 kJ/mol
由Fe3O4(s)与CO反应生成Fe(s)的热化学方程式是。
Ⅱ.一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g) 2NH3(g)△H<0;
2NH3(g)△H<0;
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________。
(2)该条件下,反应的平衡常数表达式K =______,若降低温度,K值将_____(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将_____移动(“向逆反应方向”、“向正反应方向”或“不”).
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是。
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________。
Ⅰ.充分燃烧1.4 g某有机物A生成4.4 gCO2和1.8 g H2O,该有机物蒸气的密度是相同条件下H2密度的28倍。
(1)该有机物的分子式为________。
(2)A的链状同分异构体共________种。
(3)A的链状同分异构体中含有支链的同分异构体的结构简式为________,其系统命名为________。
(4)B是A的某种同分异构体,B的磁共振氢谱中只有4个信号峰(即只有4种氢原子),B通入Br2的CCl4溶液褪色,生成化合物C。则由B生成C的化学方程式为________。
Ⅱ.油脂是高级脂肪酸甘油酯,在工业上用途广泛。
(1)以硬脂酸甘油酯为例写出油脂的皂化反应方程式为
(2)从皂化反应后的溶液中提取肥皂和甘油的过程如下:
加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是。
香豆素类化合物具有抗病毒、抗癌等多种生物活性。香豆素-3-羧酸可由水杨醛制备。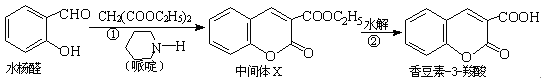
(1)水杨醛的核磁共振氢谱有______个峰。
(2)中间体X含有的官能团名称为。
(3)下列说法错误的是()(单选)
| A.中间体X不易溶于水 |
| B.1 mol 香豆素-3-羧酸最多可以与5 mol H2加成 |
| C.香豆素-3-羧酸可以与NaHCO3溶液反应放出CO2 |
| D.水杨醛和香豆素-3-羧酸都能使酸性高锰酸钾溶液褪色 |
(4)水杨醛有多种同分异构体,写出其中一种既可以发生银镜反应,又可以发生水解反应的结构简式:。
(5)香豆素-3-羧酸与足量NaOH溶液加热发生反应的化学方程式为:。
(6)反应①中的催化剂“哌啶”可以由“吡啶”合成,其反应为:
已知吡啶为环状,性质与苯类似。则吡啶的结构简式为;吡啶与混酸(浓硝酸与浓硫酸混合物)在加热条件下,发生硝化反应生成氮原子间位的一取代物的化学方程式为。
回答下列问题:
(1)用乙炔制备聚氯乙烯( )(自行选择无机原料),
)(自行选择无机原料),
请书写化学反应方程式:_______;________。
(2实验室用乙醇制乙烯的反应方程式为________。其反应类型为________。检验生成的乙烯要将导管先后通入______、_________。(填试剂名称)
(3)由溴乙烷为原料合成1,2-二溴乙烷(自行选择无机原料),
请书写化学反应方程式:_______;________。
(4)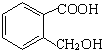 能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
能发生反应生成一种含五元环的化合物,请书写化学反应方程式_______。
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球。调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
(1)若杠杆为绝缘体,则A端_____(填“高”或“低”),发生反应的离子方程式___________。
(2)若杠杆为导体,则A端______(同上),在此过程中铁丝、杠杆、小球、CuSO4溶液构成了原电池,电极反应分别是,
正极:________________________,
负极:___________________________________。
(3)若杠杆为导体,一段时间通过杠杆电子数为0.1NA,则俩球质量相差g。