重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下,涉及的主要反应是:FeO·Cr2O3 + 24NaOH + 7KClO3 = 12Na2CrO4 + 3Fe2O3 + 7KCl + 12H2O。

试回答下列问题:
(1)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出二氧化硅、氧化铝分别与碳酸钠反应的化学方程式:______________、________________。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,写出该反应的化学方程式: 。
简述检验溶液中是否存在Fe3 +的方法是: 。
(3)操作③的目的是什么,用简要的文字和化学方程式说明: 。
(4)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式: 。
(5)铬(Cr)与铝的性质相似,试写出Cr(OH)3 溶于NaOH 溶液所发生反应的离子反应方程式: 。
Ⅰ:选择一种试剂鉴别下列各组物质,将所选试剂的化学式或名称写在横线上:
① 苯、甲苯② 苯、硝基苯、乙醇
③ 苯酚溶液、己烯、己烷、醋酸溶液
Ⅱ:为了探究苯酚和乙醇分子中羟基上氢原子的活泼性,甲、乙两位同学分别设计如下甲、乙两方案。
方案甲:
实验1:取少量无水乙醚于试管中,加入少量金属钠。
实验2:各取3mL无水乙醚于试管中,分别加入少量等物质的量的苯酚和乙醇,再投入大小相同的钠块。
方案乙:
各取少量等物质的苯酚和乙醇于试管中,均在60℃的水浴加热,待苯酚熔化后,各放入相同大小的一小块金属钠。(已知:苯酚的密度为1.07g/mL)
(1)方案甲设计实验1的目的是。
(2)方案乙中观察到:在乙醇中,钠很快与乙醇反应产生气体,溶液保持澄清;在苯酚中,钠块表面有少量气泡,且表面产生白色悬浮物,最后白色悬浮物充满苯酚熔融液。
①实验中观察到的白色悬浮物为;
②苯酚熔融液与钠的反应速率不如无水乙醇与钠的反应快,其可能原因有____________、_____________。
两位同学设计了下述两个方案, 并都认为如果观察到的现象和自己所设计的方案一致,即可确定无色气体中一定含有SO2和CO2气体。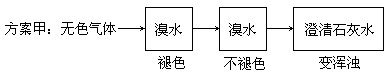
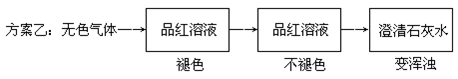
请你评价上述两个方案是否严密,并说明理由。
方案甲:_________,______________________
方案乙:_________,_______________________ 。
(1)试回答下列中学化学实验中常见仪器的有关问题:
在仪器①分液漏斗、②试剂瓶、③集气瓶、④滴瓶、⑤滴定管、⑥容量瓶、⑦量筒、⑧托盘天平中,标有“0”刻度的是(填序号,下同);标有使用温度的仪器是。用到“磨砂”处理的有。
(2)如下图是实验室制取酚醛树脂的装置图。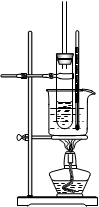
①装置中的二处错误是____________;_________。
②本实验浓盐酸作用,实验完毕后,若试管用水不易洗涤,可以加入少量_______浸泡几分钟,然后洗净。
③写出实验室制取酚醛树脂的化学方程式_______________________
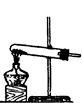
实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
| 编号 |
A |
B |
C |
发 生 装 置 |
 |
 |
 |
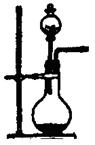
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是(写编号);
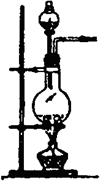
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是(写编号),写出微热时的反应方程式;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑+ 8H2O
2KCl + 2MnCl2 + 5Cl2 ↑+ 8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中元素被氧化,是氧化剂。当有1mol电子转移时,可生成气体升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示: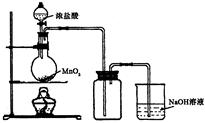
写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
海洋植物如海带、马尾藻等含有丰富的碘元素,实验室从海带中提取碘的流程如下:
(1)提取碘的过程中有关实验的操作名称①②③④
(2)写出过程②中有关反应的离子方程式;
该反应中氧化剂是,氧化产物是。
(3)提取碘的过程中,可选择得有机试剂是;
| A.酒精 | B.水 | C.四氯化碳 | D.甘油 |
在碘水中加入上述有机试剂,振荡静置,可观察到的现象是