如图所示是一系列含硫化合物的转化关系(反应中生成的水已略去),其中说法正确的是
| A.反应①说明SO2具有漂白性,反应②说明SO2具有酸性 |
| B.反应②中生成物n(Na2SO3):n(NaHSO3)=1:1时,则反应物n(SO2):n(NaOH)=1:2 |
| C.反应③④⑤均属于氧化还原反应 |
| D.工业上可利用反应②和反应④回收SO2 |
工业生产水煤气的反应为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ/mol,下列判断正确的是()
| A.反应物能量总和小于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(g) ΔH=+131.4 kJ/mol |
| C.水煤气反应中,生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+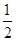 O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
O2(g)=H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的ΔH为()
| A.-488.3 kJ/mol | B.-191 kJ/mol | C.-476.8 kJ/mol | D.-1 549.6 kJ/mol |
在一定条件下,已达平衡的可逆反应:2A(g)+B(g)  2C(g),下列说法中正确的是()
2C(g),下列说法中正确的是()
A.平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=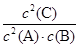 |
| B.改变条件后,该反应的平衡常数K一定不变 |
| C.如果改变压强并加入催化剂,平衡常数会随之变化 |
| D.若平衡时增加A和B的浓度,则平衡常数会减小 |
制取水煤气的反应为C(s)+H2O(g)  CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
CO(g)+H2(g) ΔH>0;在一定条件下达化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是
| A.加压 | B.升温 |
| C.增大水蒸气浓度 | D.增大碳的物质的量 |
一定条件下,可逆反应C(s)+CO2(g)  2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是()
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是()
| A.①②③④ | B.①③ | C.①② | D.①③④ |